
 Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.
Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.分析 (1)Na2S2O3+H2SO4(稀)→Na2SO4+S↓+SO2↑+H2O该反应化合价降低的、升高的都是硫元素,属于氧化还原反应中的歧化反应,据此解答;
(2)反应中S2O32-中的硫由+2价升高到硫酸根离子中的+6价,氯气中的氯元素由0价降低到-1价的氯离子,依据氧化还原反应得失电子守恒结合原子个数守恒规律配平方程式;依据S2O32-~2SO42-~8e-计算转移电子数目;
(3)依据亚硫酸钠为强电解质,完全电离,亚硫酸根离子为多元弱酸根离子,部分发生水解生成亚硫酸氢根离子和氢氧根离子,亚硫酸氢根离子继续水解生成硫离子和氢氧根离子结合水的电离,排序;
(4)Na2S溶液显碱性是因为硫化钠为强碱弱酸盐,水解生成氢氧化钠和硫氢化钠,硫化铜溶解度小于硫化锌,能够实现沉淀的转化.
解答 解:(1)Na2S2O3+H2SO4(稀)→Na2SO4+S↓+SO2↑+H2O氧化剂还原剂都是Na2S2O3,Na2S2O3中硫元素化合价部分升高,部分降低,属于氧化还原反应中歧化反应,
a.2H2S+SO2→3S↓+2H2O,硫化氢做还原剂,二氧化硫做氧化剂,属于归中反应,故不选;
b.3NaClO $\stackrel{△}{→}$ 2NaCl+NaClO3,氧化剂还原剂都是NaClO,其中的氯元素部分化合价升高,部分降低属于歧化反应,故选;
c.S+2H2SO4(浓)$\stackrel{△}{→}$ 3SO2↑+2H2O,硫做还原剂,浓硫酸做氧化剂,不属于歧化反应,故不选;
d.4P+3NaOH+3H2O→3NaH2PO2+PH3,氧化剂还原剂都是P,其中的P元素部分化合价升高,部分降低属于歧化反应,故选;
故选:bd;
(2)由给出方程式可知:反应中S2O32-中的硫由+2价升高到硫酸根离子中的+6价,氯气中的氯元素由0价降低到-1价的氯离子,依据氧化还原反应得失电子守恒,S2O32-系数为1,Cl2系数为4,依据原子个数守恒,反应方程式为:1S2O32-+4Cl2+5H2O→2SO42-+8Cl-+10H+;
若反应中生成0.2mol SO42-,依据S2O32-~2SO42-~8e-,可知转移电子数目为0.8mol;
故答案为:1、4、5H2O、2、8、10;0.8;
(3)亚硫酸钠虽然能水解,但程度不大,所以主要离子为钠离子和亚硫酸根离子,由于HSO3-还能少量水解,故氢氧根离子浓度略大于HSO3-,由于溶液呈碱性,所以H+是最小的,所以离子浓度大小关系为:[Na+]>[SO32-]>[OH-]>[HSO3-]>[H+],②是SO32-,④是HSO3-;
故答案为:SO32-,HSO3-;
(4)知Na2S溶液显碱性,其主要原因是硫离子水解,离子方程式:S2-+H2O HS-+OH-;
硫化铜溶解度小于硫化锌,往装有Na2S溶液的烧杯中加入足量的ZnCl2溶液,产生白色的ZnS沉淀;再向烧杯中滴加CuCl2溶液,沉淀转变为黑色,是因为Cu2+与S2-离子能生成更难溶于水的CuS,使平衡ZnS(s)?Zn2++S2-向右移动;
故答案为:S2-+H2O?HS-+OH-;Cu2+与S2-离子能生成更难溶于水的CuS,使平衡ZnS(s)?Zn2++S2-向右移动.
点评 本题考查了氧化还原反应规律及方程式书写,盐类水解规律、离子浓度大小比较,沉淀溶解平衡移动,熟悉盐类水解规律和溶度积规则是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 16种 | C. | 32种 | D. | 64种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g由S2、S4、S8组成的混合物中所含硫原子数为0.2NA | |
| B. | 用100ml 4mol/L盐酸与8.7g MnO2供热能制取氯气4.48L | |
| C. | 一定温度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO-的数目均为0.01NA | |
| D. | 一定条件下,将1mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
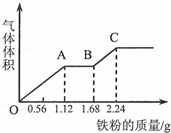 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反应为:Fe+2Fe3+═3Fe2+ | |
| D. | BC段气体产物为氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3000 mol/L | B. | 1.2000 mol/L | C. | 0.0333 mol/L | D. | 0.1333 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
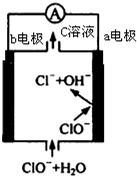 镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )| A. | 电池工作时,C溶液中的溶质是MgCl2 | |
| B. | 电池工作时,正极a附近的PH将不断增大 | |
| C. | 负极反应式:ClO --2e -+H2O═Cl-+2 OH- | |
| D. | b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵是离子化合物 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com