
 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol CH3OH(g) △H<0
CH3OH(g) △H<0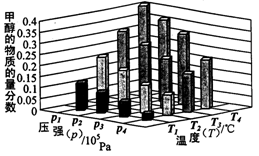
 CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0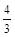 (2分,若书写单位且正确得2分,单位错误不得分) ②C、D(2分)
(2分,若书写单位且正确得2分,单位错误不得分) ②C、D(2分) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)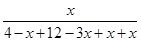 =30% x=3mol
=30% x=3mol  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)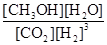 =
=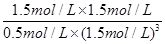 =1.33或
=1.33或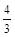


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:不详 题型:单选题
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: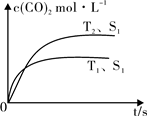
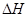 =-867kJ·mol-1
=-867kJ·mol-1 N2O4(g)
N2O4(g) 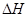 =-56.9kJ·mol-1
=-56.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1| A.+41.2 kJ?mol-1 | B.-41.2 kJ?mol-1 | C.+82.4kJ?mol-1 | D.-524.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2N (g)
2N (g) 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 O2(g)=CO2(g)的 △H= kJ ? mol-1。
O2(g)=CO2(g)的 △H= kJ ? mol-1。 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)
CH3OH(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) | A.CuO | B.CuCO3 | C.Cu(OH)2 | D.Cu2(OH)2CO3 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol| 时间(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| n (CrO42—)(mol) | 0.01 | 8.0×10-4 | 5.4×10-4 | 5.0×10-4 | |
| n (Cr2O72—)(mol) | 0 | | 4.73×10-3 | | 4.75×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com