
| 10-b |
| 10a-13 |
| Vb��0.1-Va��0.01 |
| Va+Vb |
| 10-b |
| 10a-13 |
| Vb��0.1-Va��0.01 |
| Va+Vb |


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�����÷�Ӧ:CO(g)+H2O(g)![]() CO2(g)+H2(g)����H=Q kJ��mol-1,�Ʊ�H2 .��֪�÷�Ӧ��ƽ�ⳣ��K���¶ȵĹ�ϵ��ͼ��ʾ��
CO2(g)+H2(g)����H=Q kJ��mol-1,�Ʊ�H2 .��֪�÷�Ӧ��ƽ�ⳣ��K���¶ȵĹ�ϵ��ͼ��ʾ��
����һ�ݻ��̶����ܱ�������,��850��ʱ����������Ӧ,����������ڸ����ʵ�Ũ��(mol��L�D1)��ʱ��ı仯��ϵ���±�:
| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
��֪:850��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=1.0,��ش���������:
(1)���п����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_______.
A.��λʱ���ڼ���CO(g)��Ũ�ȵ�������CO2(g)��Ũ��
B.��Ӧ�����ڵ�ѹǿ�������仯
C.���������H2(g)��Ũ�Ȳ��ٷ����ı�
D.�������������ʵ���ˮ����������
(2)Q______0(���������=������).
(3)����850��ʱ��Ӧ�����г���H2O(g),Kֵ_____(���������С�����䡱).
(4)��ƽ��ʱCO2�ķ�Ӧ����______,CO(g)��ת����Ϊ_______.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ȫ����ͨ�ߵ�ѧУ����ͳһ���������ۺ��������Ի�ѧ���㽭���������� ���ͣ������
��̼��������Ҫָ����CO2���ڽ������������ŷ��о�����Ҫ�����á�
ĿǰNH3��(NH4)2CO3�Ѿ���������ҵ��̼����������CO2�ɷ������¿��淴Ӧ��
��Ӧ��2NH3(l)��H2O(l)��CO2(g) (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
��Ӧ��NH3(l)��H2O(l)��CO2(g) (NH4)2HCO3(aq) ��H2
(NH4)2HCO3(aq) ��H2
��Ӧ��(NH4)2CO3(aq)��H2O(l)��CO2(g) 2(NH4)2HCO3(aq) ��H3
2(NH4)2HCO3(aq) ��H3
��ش��������⣺
��1����H3����H1����H2֮��Ĺ�ϵ�ǣ���H3 ��
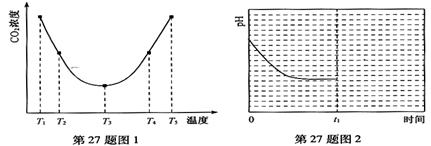
��2��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壨�õ�����Ϊϡ�ͼ�������tʱ�̣����������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ����ͼ1������
����H3 0(�������)��
����T1��T2��T4��T5�����¶����䣬������CO2����Ũ�ȳ�����ͼ1��ʾ�ı仯���ƣ�
��ԭ���� ��
�۷�Ӧ�����¶�ΪT1ʱ����ҺpH��ʱ��仯������������ͼ2��ʾ����ʱ�䵽��t1ʱ�����÷�Ӧ��ϵ�¶�������T2����ά�ָ��¶ȡ�����ͼ�л���t1ʱ�̺���Һ��pH�仯���������ߡ�
��3�����÷�Ӧ��CO2����(NH4)2CO3��ʼŨ�Ⱥ����ȷ��������£����CO2�������Ĵ�ʩ�� ��д��2������
��4������������Ҳ������ΪCO2��������� ��
| A��NH4Cl | B��Na2CO3 |
| C��HOCH2CH2OH | D��HOCH2CH2NH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ȫ����ͨ�ߵ�ѧУ����ͳһ���������ۺ��������Ի�ѧ���㽭�������棩 ���ͣ������
��̼��������Ҫָ����CO2���ڽ������������ŷ��о�����Ҫ�����á�
ĿǰNH3��(NH4)2CO3�Ѿ���������ҵ��̼����������CO2�ɷ������¿��淴Ӧ��
��Ӧ��2NH3(l)��H2O(l)��CO2(g) (NH4)2CO3(aq)
��H1
(NH4)2CO3(aq)
��H1
��Ӧ��NH3(l)��H2O(l)��CO2(g) (NH4)2HCO3(aq) ��H2
(NH4)2HCO3(aq) ��H2
��Ӧ��(NH4)2CO3(aq)��H2O(l)��CO2(g) 2(NH4)2HCO3(aq) ��H3
2(NH4)2HCO3(aq) ��H3
��ش��������⣺
��1����H3����H1����H2֮��Ĺ�ϵ�ǣ���H3 ��
��2��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壨�õ�����Ϊϡ�ͼ�������tʱ�̣����������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ����ͼ1������
����H3 0(�������)��
����T1��T2��T4��T5�����¶����䣬������CO2����Ũ�ȳ�����ͼ1��ʾ�ı仯���ƣ�
��ԭ���� ��
�۷�Ӧ�����¶�ΪT1ʱ����ҺpH��ʱ��仯������������ͼ2��ʾ����ʱ�䵽��t1ʱ�����÷�Ӧ��ϵ�¶�������T2����ά�ָ��¶ȡ�����ͼ�л���t1ʱ�̺���Һ��pH�仯���������ߡ�
��3�����÷�Ӧ��CO2����(NH4)2CO3��ʼŨ�Ⱥ����ȷ��������£����CO2�������Ĵ�ʩ�� ��д��2������
��4������������Ҳ������ΪCO2��������� ��
A��NH4Cl B��Na2CO3
C��HOCH2CH2OH D��HOCH2CH2NH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�챱���и߶�����3�·��¿���ѧ�Ծ� ���ͣ������
��ҵ�����÷�Ӧ:CO(g)+H2O(g)
 CO2(g)+H2(g)����H=Q kJ��mol-1,�Ʊ�H2 .��֪�÷�Ӧ��ƽ�ⳣ��K���¶ȵĹ�ϵ��ͼ��ʾ��
CO2(g)+H2(g)����H=Q kJ��mol-1,�Ʊ�H2 .��֪�÷�Ӧ��ƽ�ⳣ��K���¶ȵĹ�ϵ��ͼ��ʾ��

����һ�ݻ��̶����ܱ�������,��850��ʱ����������Ӧ,����������ڸ����ʵ�Ũ��(mol��L�D1)��ʱ��ı仯��ϵ���±�:
|
t/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c4 |
|
4 |
c1 |
c2 |
c3 |
c4 |
��֪:850��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=1.0,��ش���������:
(1)���п����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_______.
A.��λʱ���ڼ���CO(g)��Ũ�ȵ�������CO2(g)��Ũ��
B.��Ӧ�����ڵ�ѹǿ�������仯
C.���������H2(g)��Ũ�Ȳ��ٷ����ı�
D.�������������ʵ���ˮ����������
(2)Q______0(���������=������).
(3)����850��ʱ��Ӧ�����г���H2O(g),Kֵ_____(���������С�����䡱).
(4)��ƽ��ʱCO2�ķ�Ӧ����______,CO(g)��ת����Ϊ_______.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com