
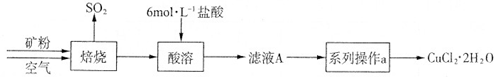


| ① |
| ② |
| ③ |
| ④ |

| ||
| ||
| 8.4g |
| 80g/mol |
| 96g/mol×0.1mol |
| 10.0g |


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
| A、0.5mo/L |
| B、0.25mol/L |
| C、0.1mol/L |
| D、1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛( )和邻羟基苯甲醛( )和邻羟基苯甲醛(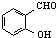 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 6.00 | 25.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.2 mol?L-1 |
| B、Y2为0.35 mol?L-1 |
| C、X2为0.3 mol?L-1 |
| D、Z为0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
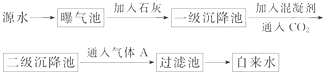
查看答案和解析>>
科目:高中化学 来源: 题型:
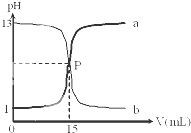 如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com