
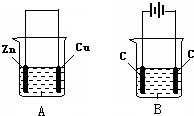
 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:分析 (1)B有外接电源,属于电解池,A中Zn与硫酸反应,两个电极活性不同,且为闭合回路;
(2)电解池中连接电源正极的为阳极,与电源负极相连对位阴极,右边C为阴极,发生还原反应,铜离子获得电子生成Cu;
(3)根据n=$\frac{m}{M}$计算Zn的物质的量,结合Zn元素化合价变化计算转移电子.
解答 解:(1)B有外接电源,属于电解池,A中Zn与硫酸反应,两个电极活性不同,且为闭合回路,构成原电池,故答案为:A;
(2)B中右边的碳连接电源的负极相,为电解池的阴极,发生还原反应,铜离子获得电子生成Cu,阴极电极反应式为:Cu2++2e-=Cu,
故答案为:阴;Cu2++2e-=Cu;
(3)6.5Zn的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,反应中Zn元素化合价由0价升高为+2价,故转移电子为0.1mol×2=0.2mol,
故答案为:0.2.
点评 本题考查原电池与电解池,比较基础,注意理解掌握原电池与电解池工作原理,有利于基础知识的巩固.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NH3 | C. | Cl2 | D. | HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCN 与KOCN中氮元素的化合价均为-3价 | |
| B. | 氰酸盐进一步被氧化的产物之一是无毒的N2 | |
| C. | OCN-与CN-中σ键与π键个数比均为1:2 | |
| D. | 完全处理含0.1 mol CN-的废水,理论上需要消耗Cl2的体积为5.6L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为:Zn-2e-=Zn2+ | ||
| C. | 正极发生氧化反应 | D. | 正极反应为:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用不活泼金属铜作电极电解饱和食盐水:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | HCO3-离子水解方程式:HCO3-+H2O═H3O++CO32- | |
| C. | 乙烯通入溴水中:C2H4+Br2═CH2BrCH2Br | |
| D. | 氯化铁溶液与碳酸氢钠溶液混合:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.
短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.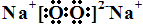 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 单位时间内消耗0.1mol X,同时生成0.2mol Y | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com