
三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子结构呈三角锥形。则下列说法正确的是( )
A.分子中N—Cl键是非极性键
B.分子中不存在孤对电子
C.它的沸点比PCl3的低
D.因N—Cl键能大,所以NCl3沸点高
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH______0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为__________________ mol·L-1·s-1;反应的平衡常数K1为________________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是
________________________________________________________________________
________________________________________________________________________。
②列式计算温度T时反应的平衡常数K2________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,下列关于实验现象的叙述不正确的是( )
A.先生成白色沉淀,加入足量氨水后沉淀消失
B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl-
C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl
D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后又消失
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种物质:①CCl4和CF4 ②Cl2和F2
③O2和N2 ④CO和N2 ⑤正戊烷与异戊烷,它们各自的分子间的范德华力前者大于后者的是( )
A.只有①② B.只有③④⑤
C.只有②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 原子半径、原子间形成的共用电子对数目。形成相同数目的共用电子对,原子半径越小,共价键的键长越短;原子半径相同,形成共用电子对数目越多,键长越短。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,含离子键的物质是( ),由极性键形成的极性分子是( ),由极性键形成的非极性分子是( ),由非极性键形成的非极性分子是( )。
A.CO2 B.Br2
C.CaCl2 D.H2O
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
O3能吸附有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示:呈V形,键角116.5°。三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键:中间O原子提供2个电子,旁边两个O原子分别各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
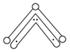
(1)题中非极性共价键是________键,特殊的化学键是________键(填“σ”或“π”)。
(2)1919年,Langmuir提出等电子体的概念:由短周期元素组成的粒子,只要其原子数相等,各原子外层电子数之和相等,也可互称为等电子体。等电子体的结构相似,物理性质相近,根据等电子原理:下列物质的分子与O3分子的结构最相似的是________(填字母)。
A.H2O B.CO2
C.SO2 D.BeCl2
(3)原子中没有跟其他原子共用的电子对叫孤电子对,那么O3分子有________对孤电子对。
(4)下列有关说法中正确的是________(填字母)。
A.臭氧和氧气互为同素异形体,它们在水中的溶解度相近
B.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
C.臭氧转化为氧气和氧气转化为臭氧均需要吸收能量
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应的水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com