
| A. | 煤 | B. | 石油 | C. | 氢气 | D. | 天然气 |
科目:高中化学 来源: 题型:解答题
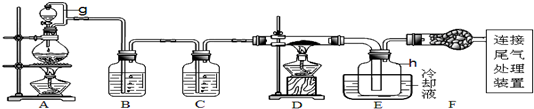
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}C$和${\;}_{6}^{13}C$ | B. | CH3CH2CH2CH3和CH3CH(CH3)2 | ||
| C. | 红磷和白磷 | D. | 冰和干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3}{8}$ mol | B. | $\frac{3}{2}$ mol | C. | 2 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼、鸡蛋、牛奶、葡萄等食物的主要营养成分是蛋白质 | |
| B. | 通过盐析可以分离、提纯蛋白质 | |
| C. | 天然蛋白质水解可以得到α-氨基酸 | |
| D. | 蛋白质遇重金属盐时会发生凝结,失去原来的活性,所以误食重金属盐能使人中毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com