
| A.碱金属单质中锂的密度最小,熔点最低 | B.碳酸钾溶液的pH<7 |
| C.乙醇与金属钾反应生成氢气 | D.用电解铯盐溶液的方法冶炼金属铯 |
科目:高中化学 来源:不详 题型:单选题
| A.32% | B.44% |
| C.56% | D.88% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.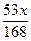 | B.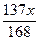 | C.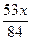 | D.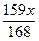 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
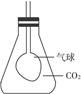
| A.Na2O | B.Na2O2 | C.KO2 | D.RbO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | | 370.000 |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
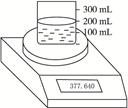
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.5mol·L-1 |
| B.2 mol·L-1 |
| C.0.2mol·L-1 |
| D.0.15mol.L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com