
分析 (1)铁和氧化铁均无剩余,且溶液中无Fe3+存在,反应生成FeSO4,设Fe、氧化铁的物质的量分别为xmol、ymol,根据二者质量及电子转移守恒列方程计算解答;
(2)铁和氧化铁与硫酸反应后溶液中溶质为FeSO4、H2SO4,根据硫酸根守恒,则n消耗(H2SO4)=n(FeSO4),据此计算出原硫酸溶液中硫酸的物质的量,进而计算硫酸的物质的量浓度.
解答 解:(1)铁和氧化铁与硫酸反应均无剩余,且溶液中无Fe3+存在,反应生成FeSO4,生成氢气为$\frac{1.68}{22.4}$=0.075mol,
设Fe、氧化铁的物质的量分别为xmol、ymol,则:
根据二者质量,可得:56x+160y=15
根据电子转移守恒,可得:2x=2y+0.075×2
联立方程,解得x=0.125 y=0.05
故m(Fe)=0.125mol×56g/mol=7g
答:混合物中铁为7g.
(2)铁和氧化铁与硫酸反应后溶液中溶质为FeSO4、H2SO4
根据铁元素守恒,则n(FeSO4)=n(Fe)+2n(Fe2O3)=0.125+0.05×2=0.225mol
根据硫酸根守恒,则n消耗(H2SO4)=n(FeSO4)=0.225mol
n剩余(H2SO4)=$\frac{1}{2}$n(H+)=2c(H+)V=$\frac{1}{2}$×1.0mo l/L×0.15L=0.075mol
n(H2SO4)=n消耗(H2SO4)+n剩余(H2SO4)=0.225+0.075=0.3mol
c(H2SO4)=$\frac{0.3mol}{0.15L}$=2mol/L
答:稀H2SO4的物质的量浓度为2mol/L.
点评 本题考查混合物计算,清楚发生的反应是解题关键,注意利用守恒思想计算,侧重考查学生分析思维能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3 | |
| B. | 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤 | |
| C. | 向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3 | |
| D. | 除去FeCl3溶液中少量的CuCl2:加入足量铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要称量NaClO固体的质量为144.0 g | |
| B. | 如图所示的仪器中,有四种是不需要的,另外还需一种玻璃仪器 | |
| C. | 配制的溶液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 | |
| D. | 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制,否则结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +172.22kJ/mol | B. | -172.22kJ/mol | C. | -392.92kJ/mol | D. | +392.92kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,7.8g苯中含有的碳碳双键数是0.3NA | |
| B. | 标准状况下,11.2L四氯甲烷所含分子数为0.5NA | |
| C. | 常温常压下,14g乙烯分子中含有的碳碳键数目为2NA | |
| D. | 1mol氢氧根离子(OH-)所含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在城区内汽车限行,限制燃煤锅炉的使用 | |
| B. | 容易产生扬尘的工厂和建筑工地停工 | |
| C. | 在灰尘较多的道路洒水,以减少扬尘的产生 | |
| D. | 要求市民出行时一定要戴防雾霾专用口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
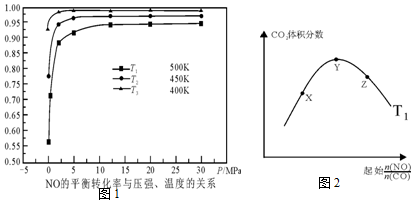
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3O2(g)=2O3(g)△H>0,则可判定O2(g)比O3(g)稳定 | |
| B. | 由1 mol H2形成2 mol H要放出热量 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2Q kJ/mol | |
| D. | 已知Ni(CO)4(g)=Ni(s)+4CO(g)△H=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g)△H=-Q kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com