
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘水不可用于鉴别苯、四氯化碳、乙醇三种无色液体 |
| B、氢气还原氧化铜实验先加热再通氢气 |
| C、配制一定物质的量浓度的硫酸溶液时.只需使用1次玻璃棒 |
| D、欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
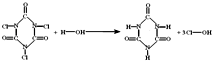
| A、分子中含有离子键和共价键 |
| B、产物HClO中Cl的化合价为+1价 |
| C、分子中C-N的键长小于C=O的键长 |
| D、上述反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 随着生活水平的提高,人们越来越关注自身的健康.以下是探讨化学物质与人体健康的有关问题:
随着生活水平的提高,人们越来越关注自身的健康.以下是探讨化学物质与人体健康的有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B、在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C、加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D、铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com