
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 |


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:

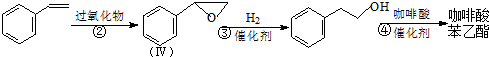
 的芳香化合物共有5种
的芳香化合物共有5种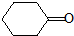 )与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉和纤维素都可以作为工业上生产葡萄糖的原料 |
| C、糖类、油脂、蛋白质在一定条件下都能发生水解反应 |
| D、蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡能导电的物质一定是单质 |
| B、金属单质都能与稀硫酸发生置换反应 |
| C、活泼金属都能从盐溶液中置换出较不活泼的金属 |
| D、在化学反应中,金属单质失电子,常作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取氢氧化铁胶体,可向沸水中加入FeCl3溶液 |
| B、加热蒸发NaHCO3溶液,最终可获得NaOH固体 |
| C、向醋酸溶液中加入固体的醋酸钠,可增大醋酸的电离度 |
| D、配制SnCl2溶液时,可加入过量的硫酸,抑制水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应及平衡常数 | 温度/℃ | ||
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g)△H1 | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?CO(g)+H2O(g)△H2 | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3 | K3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮气是还原产物,二氧化碳是氧化产物 |
| B、HNCO中碳元素被氧化 |
| C、1molHNCO参加反应失去3mol电子 |
| D、氧化产物与还原产物质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中可能大量存在Al3+、NH4+、Cl-、AlO2- |
| B、酸性溶液中可能大量存在Na+、MnO4-、SO42-、I- |
| C、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| D、0.1 mol?L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com