
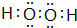 ,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).
,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).分析 A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原子半径最小的元素,则A为H元素;B、C左右相邻,C、D位于同主族,设B的原子序数为x,则C原子序数为x+1,D原子序数为x+1+8,故1+x+x+1+x+1+8=32,解得x=7,故B为N元素,C为O元素,D为S元素,则E为Cl,由此分析解答.
解答 解:(1)H与O可形成H2O或H2O2,H2O2的电子式为: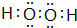 ,H2O2分子中化学键的类型是 共价键(或极性共价键和非极性共价键),故答案为:
,H2O2分子中化学键的类型是 共价键(或极性共价键和非极性共价键),故答案为: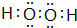 ;共价键;
;共价键;
(2)元素S、Cl最高价氧化物的水化物的酸性由强到弱为:HClO4>H2SO4; 证明S、Cl两元素非金属性强弱事实的化学反应方程式为:Cl2+H2S=S+2HCl
,故答案为:HClO4>H2SO4;Cl2+H2S=S+2HCl;
(3)1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,既能与盐酸反应,又能与氯水反应,则A为亚硫酸铵,铵根离子与氢氧根离子反应生成氨气,离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:(NH4)2SO3;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查位置结构性质的应用、无机物推断等,明确Y、Z、W的位置及原子序数的关系来推断元素是关键,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:解答题
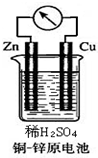 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
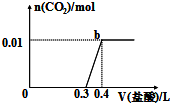 向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列对溶液中溶质组成成分判断正确的是( )
向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列对溶液中溶质组成成分判断正确的是( )| A. | 原溶液中溶质为Na2CO3和NaHCO3 | B. | 原溶液中溶质为 NaOH和Na2CO3 | ||
| C. | 原溶液中溶质为Na2CO3 | D. | 原溶液中溶质为NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| C | ||
| A | xR | B |
| D |
| A. | 4x | B. | 4x+10 | C. | 4x+5 | D. | 4x+14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是一次性电池--铜锌电池的简易装置.
如图是一次性电池--铜锌电池的简易装置.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现在,德国的许多餐馆自身就具备油脂分离技术,将”地沟油”分离出来的废油将被制成生物柴油.已知生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换反应生成新酯和新醇得到,酯交换过程可以表示为:
现在,德国的许多餐馆自身就具备油脂分离技术,将”地沟油”分离出来的废油将被制成生物柴油.已知生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换反应生成新酯和新醇得到,酯交换过程可以表示为: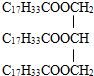 .经上述实验后得到油酸甲酯15.40g,则该实验中生物柴油(全以油酸甲酯计量)的产率为57.8%%.
.经上述实验后得到油酸甲酯15.40g,则该实验中生物柴油(全以油酸甲酯计量)的产率为57.8%%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
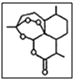 ,其中的过氧基(-O-O-)具有强氧化性.请回答下列问题:
,其中的过氧基(-O-O-)具有强氧化性.请回答下列问题: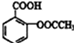 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: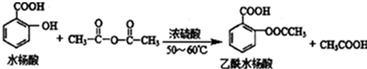
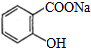 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com