

 (g) =" 2" CO(g) ��H=��222KJ/mol
(g) =" 2" CO(g) ��H=��222KJ/mol l
l ��
��| A�������¶� | B������ѹǿ |
| C��ѡ����ʵĴ��� | D������H2O(g)��Ũ�� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2 SO3 (g); ��H <0, �÷�Ӧ�����Ṥҵ������Ӧ��ȡ�����������ǣ� ��
2 SO3 (g); ��H <0, �÷�Ӧ�����Ṥҵ������Ӧ��ȡ�����������ǣ� ��| A�����¡���ѹ������ | B�����˵��¶ȡ���ѹ������ |
| C�����¡���ѹ������ | D�����˵��¶ȡ���ѹ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO��g����6H2O��g������������ȷ����(���� )��
4NO��g����6H2O��g������������ȷ����(���� )��| A���ﵽƽ��ʱ��4v��(O2)=5v��(NO) |
| B������λʱ��������x mol NO��ͬʱ������x mol NH3,��Ӧ�ﵽƽ��״̬�� |
| C���ﵽƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ�������� |
| D����ѧ��Ӧ�����ʹ�ϵ�ǣ�2v��(NH3)=3v��(H2O) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������25.3% | B��С��25.3% | C������25.3% | D��Լ����25.3% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 qZ(g) ��H��0��m��n��q�������һ�����ܱ�������Ͷ�뷴Ӧ��ﵽƽ�⣬����������ȷ����( )
qZ(g) ��H��0��m��n��q�������һ�����ܱ�������Ͷ�뷴Ӧ��ﵽƽ�⣬����������ȷ����( ) | A��ͨ������������ѹǿ��ƽ�������ƶ� |
| B���ټ���X����Ӧ���յ��������� |
| C������Y�����ʵ�����X��ת���ʼ�С |
D�������¶ȣ� ��ֵ��С ��ֵ��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g) ��H<0���ڲ�ͬ�¶ȣ�T1��T2����ѹǿ��P1�� P2���£�����Z�����ʵ���(nz)�뷴Ӧʱ��(t)�Ĺ�ϵ��ͼ��ʾ.�����ж���ȷ����
2Z(g) ��H<0���ڲ�ͬ�¶ȣ�T1��T2����ѹǿ��P1�� P2���£�����Z�����ʵ���(nz)�뷴Ӧʱ��(t)�Ĺ�ϵ��ͼ��ʾ.�����ж���ȷ����
| A��T1<T2,P1<P2 | B��T1<T2,P1>P2 |
| C��T1>T2,P1>P2 | D��T1>T2,P1<P2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
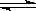 xC��g��,��������ͼ����ʾ��ϵ���ɴ��ƶ϶�ͼ����ȷ˵����
xC��g��,��������ͼ����ʾ��ϵ���ɴ��ƶ϶�ͼ����ȷ˵����
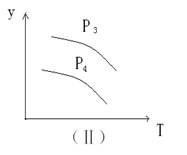
| A��P3��P4 , y���ʾA�İٷֺ��� |
| B��P3��P4 , y���ʾB�İٷֺ��� |
| C��P3��P4 , y���ʾ���������ܶ� |
D��P3��P4 , y���ʾ�������� ƽ����Է������� ƽ����Է������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)��H2O(g)��ƽ�ⳣ�����¶ȱ仯���±���
CO(g)��H2O(g)��ƽ�ⳣ�����¶ȱ仯���±���| t/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| | A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
 CO(g)��H2O(g)���ڸ������ڸ����ʵ�Ũ�ȱ仯
CO(g)��H2O(g)���ڸ������ڸ����ʵ�Ũ�ȱ仯 ���£�
���£�| ʱ��/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O (mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 3Z(��)����֪����1 molX��3molY���ﵽƽ�������a mol Z��
3Z(��)����֪����1 molX��3molY���ﵽƽ�������a mol Z�� X��6 mol Y���ﵽƽ���Z�����ʵ���Ϊ ��
X��6 mol Y���ﵽƽ���Z�����ʵ���Ϊ ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com