
| A. | 离子键 | B. | 氢键 | C. | 极性键 | D. | 金属键 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在城区内汽车限行,限制燃煤锅炉的使用 | |
| B. | 容易产生扬尘的工厂和建筑工地停工 | |
| C. | 在灰尘较多的道路洒水,以减少扬尘的产生 | |
| D. | 要求市民出行时一定要戴防雾霾专用口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢是+1价 | |
| B. | NaH中阴离子半径比锂离子半径小 | |
| C. | NaH中阴离子的电子层排布与氦原子相同 | |
| D. | NaH中阴离子可被还原成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
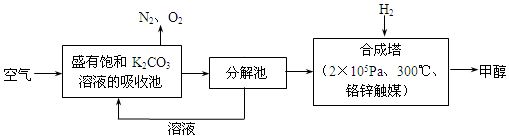

查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:实验题
(I)检验某溶液中是否含SO42-的正确操作顺序是:取少量未知溶液,加入____________________,若出现 现象,再加入_____________,若出现 现象,证明原溶液含有SO42-;BaSO4和NaCl的悬浊液在分离过程中涉及到过滤、洗涤沉淀操作,证明滤纸上的BaSO4沉淀已经洗净的方法是_______________。
(Ⅱ)现有A、B两种有机物的液体混合物,如果A、B互溶,且相互不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题:
(1)分离上述A、B的混合物,常用的方法是 ,需要的玻璃仪器有酒精灯、温度计、牛角管、蒸馏烧瓶,还有 和 (每空1分)。
(2)应用上述分离操作,首先得到的物质是 。
(3)点燃酒精灯前的最近一步操作是 。
(Ⅲ)下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是 mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则需要取 mL的该硫酸。将上述硫酸进行稀释的实验操作为 。
(3)用上述硫酸配制240 mL 4.6 mol·L-1的稀硫酸,实验仪器有:
①50 mL量筒 ②100 mL量筒 ③托盘天平 ④玻璃棒
⑤250 mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时使用选用仪器的先后顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量/mol 时间 | n(N2H4) | N(NO2) | N(N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
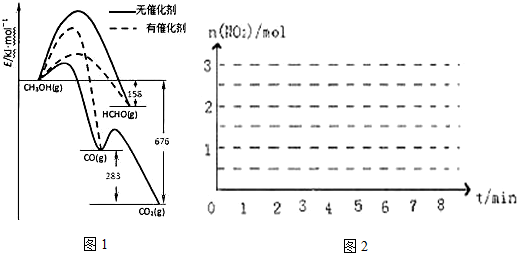
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
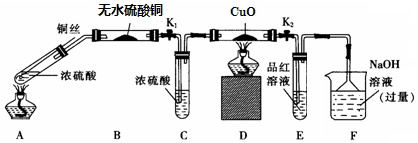
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com