
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ?mol-1 | a | b | c |

| ||
| ||
| 3.36L |
| 22.4L/mol |
| 0.3mol |
| 3-2 |


科目:高中化学 来源: 题型:
| A、AgNO3 |
| B、CuSO4 |
| C、MgSO4 |
| D、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |

| 充电 |
| 放电 |
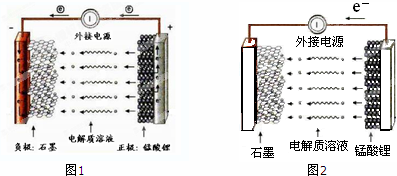
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | ||
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入足量SO2的溶液中:Fe2+、Na+、SO42-、ClO- |
| B、常温下,c(H+)=10-3mol/L的溶液中:Na+、Fe3+、HCO3-、K+ |
| C、水电离出的c(OH-)=10-13mol/L的溶液中:Ba2+、Cl-、NO3-、I- |
| D、遇酚酞显红色的溶液中:AlO2-、HCO3-、K+、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com