
| A. | 用托盘天平称取28.6g Na2CO3•10H2O晶体 | |
| B. | 将Na2CO3固体放入容器瓶中,加水至刻度线 | |
| C. | 定容时俯视液面,所得溶液浓度偏低 | |
| D. | 加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 |
分析 依据m=CVM计算需要溶质的质量;分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$进行分析,凡是使n偏大,或者使V偏小的操作,都会使溶液浓度偏高,反之,溶液浓度偏低.
解答 解:A.配置100mL 1.0mol/L Na2CO3溶液,需要Na2CO3•10H2O晶体质量m=1.0mol/L×0.1L×286g/mol=28.6g,故A正确;
B.容量瓶为精密仪器,不能用来溶解固体,故B错误;
C.定容时俯视液面,导致溶液体积偏小,溶液浓度偏高,故C错误;
D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体,导致溶质的物质的量偏小,溶液浓度偏低,故D错误;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确有关物质的量浓度计算公式及误差分析方法是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
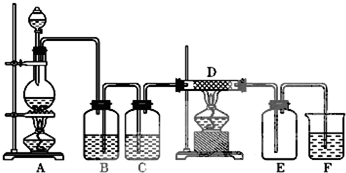
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO3>H2CO3 | B. | 熔沸点:HF>HCl | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:Na2CO3>CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
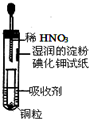
| A. | 吸收剂可以是NaOH溶液 | B. | 试管上部的气体始终为无色 | ||
| C. | 小试管中溶液最终呈蓝色 | D. | 试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
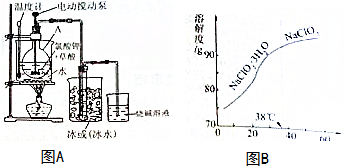
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
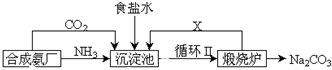
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3 | B. | CH≡CH与CH2=CH2 | ||
| C. | ${\;}_{8}^{16}$O与${\;}_{8}^{18}$O | D. | CH3-CH2-CH2-CH3与CH3-CH2-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com