
”¾ĢāÄæ”æĻĀĶ¼ŹĒŹµŃéŹŅÖĘČ”SO2²¢ŃéÖ¤SO2ijŠ©ŠŌÖŹµÄ×°ÖĆĶ¼”£Čō¹Ū²ģµ½×°ÖĆ¢ÜÖŠÓŠµ»ĘÉ«³ĮµķÉś³É£¬¢ŻÖŠµÄäåĖ®ĶŹÉ«£ØŅŃÖŖŅņŗ¬ÓŠBr2¶ųäåĖ®³Źŗģ×ŲÉ«£©£¬Ēė»Ų“š£ŗ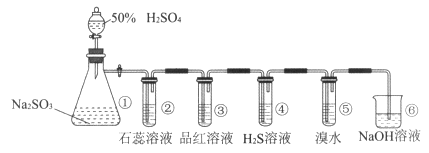
£Ø1£©¢ŁÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ”£
£Ø2£©¢ŚÖŠµÄŹµŃéĻÖĻóŹĒ”£
£Ø3£©¢ŪµÄŹµŃéĻÖĻóŹĒ £¬ Ö¤Ć÷SO2ÓŠŠŌ”£
£Ø4£©¢ÜÖŠSO2×ö¼Į”£
£Ø5£©¢ŻÖŠ·“Ӧɜ³ÉĮ½ÖÖĒæĖį£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ £¬ µ±1 molSO2²ĪÓė·“Ó¦Ź±£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŹĒ”£
£Ø6£©¢ŽµÄ×÷ÓĆŹĒ”£
”¾“š°ø”æ
£Ø1£©SO32-+2H+= H2O+SO2”ü
£Ø2£©ČÜŅŗ±äĪŖŗģÉ«
£Ø3£©Ę·ŗģČÜŅŗĶŹÉ«£»Ęư׊Ō
£Ø4£©Ńõ»Æ
£Ø5£©SO2+Br2+2H2O=4H++2Br-+SO42-£»2mol
£Ø6£©ĪüŹÕĪ²Ęų£¬·ĄÖ¹»·¾³ĪŪČ¾
”¾½āĪö”æ
£Ø1£©¢ŁÖŠĪŖŃĒĮņĖįÄĘŗĶĮņĖį·“Ӧɜ³É¶žŃõ»ÆĮņĘųĢ壬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖSO32-+2H+= H2O+SO2”ü£»
£Ø2£©¶žŃõ»ÆĮņŗĶĖ®·“Ӧɜ³ÉŃĒĮņĖį£¬ŃĒĮņĖįĪŖČõĖį£¬æÉŅŌŹ¹×ĻÉ«ŹÆČļŹŌŅŗ±äŗģ£¬¢ŚÖŠµÄŹµŃéĻÖĻóŹĒČÜŅŗ±äĪŖŗģÉ«£»
£Ø3£©¶žŃõ»ÆĮņÓėĘ·ŗģ»ÆŗĻÉś³ÉĪŽÉ«ĪļÖŹ£¬ÄÜŹ¹Ę·ŗģČÜŅŗĶŹÉ«£¬Ö¤Ć÷¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō£»
£Ø4£©¢ÜÖŠÓŠµ»ĘÉ«³ĮµķÉś³É£¬ĖµĆ÷SO2ÓėĮņ»ÆĒā·“Ӧɜ³ÉS£¬SO2×öŃõ»Æ¼Į£»
£Ø5£©¢ŻÖŠäåĖ®ĶŹÉ«£¬·“Ӧɜ³ÉĮ½ÖÖĒæĖį£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒSO2+Br2+2H2O=4H++2Br-+SO42- £»ĮņŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ+4±äĪŖ+6£¬µ±1 molSO2 ²ĪÓė·“Ó¦Ź±£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŹĒ2mol£»
£Ø6£©¶žŃõ»ÆĮņÓŠ¶¾£¬²»ÄÜÖ±½ÓÅŷŵ½æÕĘųÖŠ£¬¶žŃõ»ÆĮņÄÜÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉŃĒĮņĖįÄĘŗĶĖ®£¬ĖłŅŌÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕĪ²Ęų£¬·ĄÖ¹»·¾³ĪŪČ¾”£
£Ø1£©ĒæĖįÖĘČõĖį£ŗŃĒĮņĖįÄĘŗĶĮņĖį·“Ӧɜ³É¶žŃõ»ÆĮņĘųĢå
£Ø2£©×ĻÉ«ŹÆČļŹŌŅŗŃéÖ¤ČÜŅŗµÄĖį¼īŠŌ£ŗ¶žŃõ»ÆĮņŹĒĖįŠŌŃõ»ÆĪļ£¬ČÜÓŚĖ®³ŹĖįŠŌ
£Ø3£©æ“µ½Ę·ŗģ£¬Ļėµ½¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō£ØÓėĘ·ŗģ»ÆŗĻÉś³ÉĪŽÉ«ĪļÖŹÓöČČ»į»Öø“ŗģÉ«£©
£Ø4£©¢ÜÖŠÓŠµ»ĘÉ«³ĮµķÉś³É£¬ĖµĆ÷SO2ÓėĮņ»ÆĒā·“Ӧɜ³ÉS£¬SO2×öŃõ»Æ¼Į£»
£Ø5£©¶žŃõ»ÆĮņÓöäåĖ®£ØĀČĖ®£©Éś³ÉĮņĖįŗĶHBr£ØŃĪĖį£©
£Ø6£©ÓŠ¶¾ĘųĢåŠčĪ²Ęų“¦Ąķ£Ø¶žŃõ»ÆĮņŹĒĖįŠŌŃõ»ÆĪļ£¬ÓĆ¼īČÜŅŗĪüŹÕ£©



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠĖȤŠ”×éÖʱøĒāŃõ»ÆŃĒĢś³Įµķ£®
ŹµŃé1 |
| ŹµŃéĻÖĻó |
ŅŗĆęÉĻ·½²śÉś°×É«Šõד³Įµķ£¬ŃøĖŁ±äĪŖ»ŅĀĢÉ«£¬Õńµ“£¬ŹŌ¹Ü±ŚÉĻÓŠŗģŗÖÉ«³ĮµķÉś³É£® |
£Ø1£©ŹµŃé1ÖŠ²śÉś°×É«³ĮµķµÄĄė×Ó·½³ĢŹ½ŹĒ £®
£Ø2£©ĪŖĮĖĢ½¾æ³Įµķ±ä»ŅĀĢÉ«µÄŌŅņ£¬øĆŠ”×éĶ¬Ń§Õ¹æŖČēĻĀĢ½¾æ£ŗ ¢Ł¼×Ķ¬Ń§ĶĘ²ā»ŅĀĢÉ«ĪļÖŹĪŖFe£ØOH£©2ŗĶFe£ØOH£©3»ģŗĻĪļ£®²éŌÄ׏ĮĻŗóøł¾Żµ÷É«ŌĄķČĻĪŖ°×É«ŗĶŗģŗÖÉ«µÄµ÷ŗĶÉ«²»æÉÄÜŹĒ»ŅĀĢÉ«£¬²¢Éč¼ĘŹµŃéÖ¤Źµ»ŅĀĢÉ«ĪļÖŹÖŠ²»ŗ¬ÓŠFe£ØOH£©3 £¬ ·½°øŹĒ £®
¢ŚŅŅĶ¬Ń§²éŌÄĪÄĻ×£ŗFe£ØOH£©2ŌŚ“óĮæSO42©“ęŌŚµÄĒéæöĻĀŠĪ³ÉFe6£ØSO4£©2£ØOH£©4O3£ØŅ»ÖÖŃõ»ł¼īŹ½ø“ŃĪ£©£®²¢Éč¼Ę¶Ō±ČŹµŃéÖ¤ŹµøĆ¼ŁÉč£ŗĻņŹŌ¹ÜÖŠ¼ÓČė £¬ ŌŁĶłŹŌ¹ÜÖŠ¼ÓČė £¬ Õńµ“£¬ĻÖĻóÓėŹµŃé1ĻąĶ¬£¬½įĀŪŹĒøĆ¼ŁÉč²»³ÉĮ¢£®
¢ŪŅŅĶ¬Ń§¼ĢŠų²éŌÄĪÄĻ×£ŗFe£ØOH£©2³Įµķ¾ßÓŠ½ĻĒæµÄĪüø½ŠŌÄÜ£¬»ŅĀĢÉ«æÉÄÜŹĒÓÉFe£ØOH£©2±ķĆęĪüø½Fe2+ŅżĘš£®ĶĘ²āĖłÓƵÄĮņĖįŃĒĢśČÜŅŗµÄÅضČÓ¦Ō½Š”Ō½ŗĆ£»ĒāŃõ»ÆÄĘČÜŅŗÅضČÓ¦Ō½“óŌ½ŗĆ£®Éč¼ĘĮĖČēĻĀŹµŃé·½°ø£ŗ
ŹŌ¹ÜÖŠ10mL | µĪ¼Ó | ŹµŃéĻÖĻó | |
ŹµŃé2 | 6mol/L | 0.2mol/L FeSO4ČÜŅŗ | ²śÉśŠüø”ÓŚŅŗĆęµÄ°×É«³Įµķ£Ø“ųÓŠÉŁĮæ»ŅĀĢÉ«£©£¬³ĮµķĻĀ³Įŗ󣬓ó²æ·Ö»ŅĀĢÉ«±äĪŖ°×É«³Įµķ |
ŹµŃé3 | 6mol/L | 0.1mol/L FeSO4ČÜŅŗ | ²śÉśŠüø”ÓŚŅŗĆęµÄ°×É«³Įµķ£Ø“ųÓŠ¼«ÉŁĮæ»ŅĀĢÉ«£©£¬³ĮµķĻĀ³Įŗ󣬵ײ涼ĪŖ°×É«³Įµķ |
øĆŹµŃéµĆ³öµÄ½įĀŪŹĒ £¬ ÄÜĖµĆ÷»ŅĀĢÉ«ŹĒÓÉFe£ØOH£©2±ķĆęĪüø½Fe2+ŅżĘšµÄÖ¤¾ŻŹĒ £® ±ūĶ¬Ń§ČĻĪŖøĆŹµŃé·½°ø²»×ćŅŌÖ¤Ć÷»ŅĀĢÉ«ŹĒÓÉFe£ØOH£©2±ķĆęĪüø½Fe2+ŅżĘšµÄ£¬»¹Šč²¹³äµÄŹµŃéŹĒ £¬ Ö¤Ć÷øĆ¼ŁÉč³ÉĮ¢£®
£Ø3£©±ūĶ¬Ń§Ģ½¾æĪĀ¶Č¶ŌĒāŃõ»ÆŃĒĢśÖʱøŹµŃéµÄÓ°Ļģ£ŗȔɣĮæ»ŅĀĢÉ«³Įµķ£¬ŌŚĖ®Ō”ÖŠ¼ÓČČ£¬ŃÕÉ«ÓÉ»ŅĀĢ±ä°×£¬ĒŅÓŠŠõד°×É«³ĮµķĻĀ³Į£¬ŌŅņĪŖ £®
£Ø4£©øł¾ŻŅŌÉĻŹµŃéĢ½¾æ£¬Čō¾”æÉÄÜÖʵư×É«Fe£ØOH£©2³Įµķ£¬ŠčŅŖæŲÖʵďµŃéĢõ¼ž £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
£Ø1£©¹čĖįÄʵÄĖ®ČÜŅŗĖ×³Ę £¬ ĻņĢ¼ĖįĒāÄĘČÜŅŗÖŠµĪČė1”«2µĪ·ÓĢŖČÜŅŗ£¬ČÜŅŗĻŌÉ«”£
£Ø2£©Fe(OH)3½ŗĢåæÉÓĆ×÷¾»Ė®¼Į£¬Č”ÉŁĮæFe(OH)3½ŗĢåÓŚŹŌ¹ÜÖŠ£¬ĻņŹŌ¹ÜÖŠÖš½„µĪ¼ÓĻ”ŃĪĖįÖĮ¹żĮ棬²śÉśµÄĻÖĻóĪŖ”£
£Ø3£©ŹµŃéŹŅŹ¢×°NaOHČÜŅŗµÄŹŌ¼ĮĘæ²»ÄÜÓĆ²£Į§Čū£¬ŅŌ·ĄÖ¹·¢Éś·“Ó¦£ŗ£ØĄė×Ó·½³ĢŹ½£©”£
£Ø4£©½«AlŗĶNaµÄµ„ÖŹĶ¬Ź±¼ÓČėµ½Ņ»¶ØĮæµÄĖ®ÖŠ£¬³ä·Ö·“Ó¦ŗ󣬷¢ĻÖ¼ČĪŽ³ĮµķÉś³ÉÓÖĪŽ²ŠĮō½šŹō“ęŌŚ£¬ĒėÓĆĮ½øö»Æѧ·“Ó¦·½³ĢŹ½±ķŹ¾Ęä±ä»Æ£ŗ
¢Ł”£
¢Ś”£
£Ø5£©ŅŃÖŖ£ŗ5NH4NO3 ![]() 2HNO3+4N2”ü+9H2O£¬ŌņøĆ·“Ó¦ÖŠŃõ»Æ²śĪļÓė»¹Ō²śĪļµÄÖŹĮæ±ČĪŖ”£
2HNO3+4N2”ü+9H2O£¬ŌņøĆ·“Ó¦ÖŠŃõ»Æ²śĪļÓė»¹Ō²śĪļµÄÖŹĮæ±ČĪŖ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌĀĒņŗ¬ÓŠH”¢He”¢N ”¢Na”¢Mg”¢Al”¢Fe”¢SiµČŌŖĖŲ£¬ŹĒČĖĄąĪ“Ą“µÄ׏Ō“±¦æā£¬°“ŅŖĒóĢīæÕ”£
£Ø1£©Na+½į¹¹Ź¾ŅāĶ¼ £¬ ŌŚNa”¢Al”¢FeČżÖÖ½šŹōŌŖĖŲÖŠ£¬ĘäĖłŠĪ³ÉŃõ»ÆĪļÖÖĄą×ī¶ąµÄŌŖĖŲŹĒ £¬ ĖłŠĪ³ÉµÄŃõ»ÆĪļÖŠŹŹŅĖ×öÄĶ»š²ÄĮĻµÄŌŖĖŲŹĒ£»
£Ø2£©ŌĀĒņÉĻijæóŹÆ¾“¦ĄķµĆµ½µÄMgOÖŠŗ¬ÓŠSiO2 £¬ ³żČ„SiO2µÄĄė×Ó·½³ĢŹ½ĪŖ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠ”×éŌŚŃŠ¾æNa2SO3ČÜŅŗ”¢FeCl3ČÜŅŗŠŌÖŹ¼°·“Ó¦Ź±£¬½ųŠŠĮĖĻĀĮŠŹµŃé£ŗ
£Ø1£©Č”1molL©1µÄNa2SO3ČÜŅŗÖĆÓŚæÕĘųÖŠ£¬²āµĆĘäpHĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ 
¢Ł×ī³õ£¬Na2SO3ČÜŅŗpH=7.8£¬½āŹĶĘäŌŅņµÄĄė×Ó·½³ĢŹ½ŹĒ £®
¢ŚtŹ±¼ä¶ĪÄŚ£¬Ōģ³ÉĘäpH·¢ÉśÉĻŹö±ä»Æ£¬ÓĆĄė×Ó·½³ĢŹ½½āŹĶŹĒ £®
£Ø2£©Ģ½¾æNa2SO3ČÜŅŗÓėFeCl3ČÜŅŗŹµ¼Ź·“Ó¦µÄĒéæö£ŗ ŹµŃ颔
×°ÖĆ | ²Ł×÷ | ĻÖĻó |
| Ļņ2mL1molL©1FeCl3ČÜŅŗÖŠ£¬ÖšµĪµĪ¼Ó1moL©1Na2SO3ČÜŅŗ2mL | ČÜŅŗ»ĘÉ«Öš½„¼ÓÉī£¬×īÖÕµĆŗģŗÖÉ«ČÜŅŗ£ØW£© |
ŹµŃ颢
×°ÖĆ | ²Ł×÷ | ĻÖĻó |
| Č”1mLČÜŅŗWÓŚŹŌ¹ÜÖŠ£¬ĻņĘäµĪ¼Ó¹żĮæŃĪĖį£¬ŌŁµĪ¼Ó5µĪBaCl2ČÜŅŗ | ²śÉś°×É«³Įµķ |
¢ŁŹµŃ颢֤Ć÷£¬ČÜŅŗÖŠŗ¬ÓŠĄė×Ó£»
¢Ś¶ŌNa2SO3ČÜŅŗÓėFeCl3ČÜŅŗŹµ¼Ź·“Ó¦“ęŌŚĮ½ÖÖČĻŹ¶£ŗ
ČĻŹ¶¢ń£®·“Ó¦ÖŠFe3+ĶźČ«×Ŗ»ÆĪŖFe2+ £¬ WČÜŅŗÖŠc£ØFe2+£©Ņ»¶Øŗܓ󣬷“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ £®
ČĻŹ¶¢ņ£®WČÜŅŗÖŠc£ØFe2+£©Ó¦øĆ¼«Š”£¬·ńŌņWČÜŅŗ²»»į³ŹŗģŗÖÉ«£®
£Ø3£©×ŹĮĻĻŌŹ¾£ŗFe2+³ŹµĀĢÉ«”¢FeSO3ŹĒÄ«ĀĢÉ«³Įµķ”¢¼īŹ½ĮņĖįĢś[Fe4£ØOH£©2£ØSO4£©5]ČÜŅŗĪŖŗģŗÖÉ«£® ¢ŁŹµŃéÖŠŹ¼ÖÕĪ“³öĻÖÄ«ĀĢÉ«³Įµķ£¬ĖµĆ÷c£ØFe2+£©¼«Š”£¬ĘäŌŅņÓĆĄė×Ó·½³ĢŹ½½āŹĶŹĒ £®
¢ŚŹµŃé¹ż³ĢŗĶ½į¹ūĻŌŹ¾£¬O2”¢Fe3+”¢SO42©µÄŃõ»ÆŠŌĒæČõĖ³ŠņŹĒ £®
¢ŪČōFe4£ØOH£©2£ØSO4£©5ŹĒŌģ³ÉČÜŅŗW³ŹŗģŗÖÉ«µÄŌŅņÖ®Ņ»£¬ĘäŠĪ³ÉµÄ»Æѧ·½³ĢŹ½ŹĒ £®
¢ÜÓĆ¼¤¹ā±ŹÕÕÉäWČÜŅŗ£¬·¢ĻÖÓŠ¶”“ļ¶ūĻÖĻó£¬ÓĆĄė×Ó·½³ĢŹ½½āŹĶŌŅņŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŹµŃé¹ż³ĢČēĶ¼ĖłŹ¾£¬ŌņĶ¼¢ŪŹŌ¹ÜÖŠµÄĻÖĻóŹĒ£Ø £© 
A.ĶʬČܽā£¬²śÉśĪŽÉ«ĘųĢ壬øĆĘųĢåÓöæÕĘų±äĪŖŗģ×ŲÉ«
B.ĶʬČܽā£¬²śÉśĪŽÉ«ĘųĢ壬øĆĘųĢåÓöµ½æÕĘų²»±äÉ«
C.ĶʬČܽā£¬·Å³öŗģ×ŲÉ«ÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢå
D.ĪŽĆ÷ĻŌĻÖĻó£¬ŅņĻ”ĮņĖį²»ÓėĶ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé·½°ø²»ŗĻĄķµÄŹĒ £Ø £©
A.ÓƱ„ŗĶĢ¼ĖįÄĘČÜŅŗ³żČ„ŅŅĖįŅŅõ„ÖŠ»ģÓŠµÄŅŅĖįµČŌÓÖŹ
B.ÓĆ¼ÓČėÅØäåĖ®µÄ·½·Ø·ÖĄė±½ŗĶ±½·ÓµÄ»ģŗĻĪļ
C.ÖʱøFeC13ČÜŅŗŹ±£¬ĻČ½«¹ĢĢåČÜÓŚ½ĻÅØŃĪĖį£¬ŌŁ¼ÓĖ®Ļ”ŹĶ
D.ÓĆøÉŌļµÄpHŹŌÖ½²āĮæijĖįČÜŅŗµÄpH
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æLi©CuO¶ž“Īµē³ŲµÄ±ČÄÜĮæøß”¢¹¤×÷ĪĀ¶Čæķ£¬ŠŌÄÜÓÅŅģ£¬¹ć·ŗÓ¦ÓĆÓŚ¾üŹĀŗĶæÕ¼äĮģÓņ£®
£Ø1£©Li©CuOµē³ŲÖŠ£¬½šŹōļ®×ö¼«£®
£Ø2£©±ČÄÜĮæŹĒÖøĻūŗĵ„Ī»ÖŹĮæµÄµē¼«ĖłŹĶ·ÅµÄµēĮ棬ÓĆĄ“ŗāĮæµē³ŲµÄÓÅĮÓ£®±Č½ĻLi”¢Na”¢Al·Ö±š×÷ĪŖµē¼«Ź±±ČÄÜĮæµÄ“󊔣ŗ £®
£Ø3£©ĶعżČēĻĀ¹ż³ĢÖʱøCuO Cu ![]() CuSO4ČÜŅŗ
CuSO4ČÜŅŗ ![]() Cu2£ØOH£©2CO3³Įµķ
Cu2£ØOH£©2CO3³Įµķ ![]() CuO
CuO
¢Ł¹ż³Ģ¢ń£¬H2O2µÄ×÷ÓĆŹĒ £®
¢Ś¹ż³Ģ¢ņ²śÉśCu2£ØOH£©2CO3µÄĄė×Ó·½³ĢŹ½ŹĒ £®
¢Ū¹ż³Ģ¢ņ£¬½«CuSO4ČÜŅŗ¼Óµ½Na2CO3ČÜŅŗÖŠ£¬ŃŠ¾æ¶žÕß²»Ķ¬ĪļÖŹµÄĮæÖ®±ČÓė²śĘ·“æ¶ČµÄ¹ŲĻµ£ØÓĆ²ā¶ØĶŌŖĖŲµÄ°Ł·Öŗ¬ĮæĄ“±ķÕ÷²śĘ·µÄ“æ¶Č£©£¬½į¹ūČēĻĀ£ŗ
ŅŃÖŖ£ŗCu2£ØOH£©2CO3ÖŠĶŌŖĖŲµÄ°Ł·Öŗ¬ĮæĪŖ57.7%£®
¶žÕß±ČÖµĪŖ1£ŗ0.8Ź±£¬²śĘ·ÖŠæÉÄÜŗ¬ÓŠµÄŌÓÖŹŹĒ £¬ ²śÉśøĆŌÓÖŹµÄŌŅņŹĒ £®
¢Ü¹ż³Ģ¢ó·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ £®
£Ø4£©Li©CuO¶ž“Īµē³ŲŅŌŗ¬Li+µÄÓŠ»śČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬Ę乤×÷ŌĄķŹ¾ŅāČēĶ¼2£®·ÅµēŹ±£¬Õż¼«µÄµē¼«·“Ó¦Ź½ŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņ100mL NaOHČÜŅŗÖŠĶØČėŅ»¶ØĮæµÄCO2ĘųĢ壬³ä·Ö·“Ó¦ŗó£¬ŌŁĻņĖłµĆČÜŅŗÖŠÖšµĪ¼ÓČė0.2mol/LµÄŃĪĖį£¬²śÉśCO2µÄĢå»żÓėĖł¼ÓŃĪĖįĢå»żÖ®¼ä¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø £© 
A.ŌNaOHČÜŅŗµÄÅضČĪŖ0.1mol/L
B.ĶØČėCO2µÄĢå»żĪŖ448mL
C.ĖłµĆČÜŅŗµÄČÜÖŹ³É·ÖµÄĪļÖŹµÄĮæÖ®±ČĪŖ£ØNaOH£©£ŗ£ØNa2CO3£©=1£ŗ3
D.ĖłµĆČÜŅŗµÄČÜÖŹ³É·ÖµÄĪļÖŹµÄĮæÖ®±ČĪŖ£ØNaHCO3£©£ŗ£ØNa2CO3£©=2£ŗ1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com