
【题目】已知可逆反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1025kJmo1﹣l . 若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.
B.
C.
D.
【答案】D
【解析】解:A、该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故A正确; B、该反应是一个反应前后气体体积增大的放热反应,增大压强平衡向逆反应方向移动,导致一氧化氮的含量减少,故B正确;
C、催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡的时间,故C正确;
D、该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故D错误;
故选D.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】物质A—J间的转化关系如下图所示,A、C为金属氧化物,其中A为红棕色粉末,B、D是生活中常见金属单质,F、J是难溶于水的白色化合物,G、J受热后容易分解

(1)A的化学式是_________,A与B反应的反应类型是________(填四大基本反应类型)。
(2)I→J反应的离子方程式是___________________________________________。
(3)F转化为G的过程中观察到的现象是__________,反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下1molL﹣1的NaOH溶液中,由水电离出的c(OH﹣)=molL﹣1 .
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等.若将两溶液稀释相同的倍数后,pH(A)pH(B) (填“>”、“=”或“<”).现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A)V(B)(填“>”、“=”或“<”).
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR﹣ , HR﹣R2﹣+H+ , 若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1 , 则0.1molL﹣1H2R溶液中c(H+)(0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 .
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为(用化学式表示).
②向NaCN溶液中通入少量的CO2 , 发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 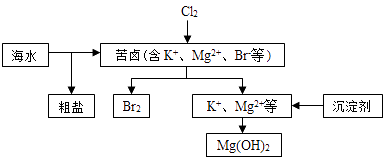
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在无色透明的酸性溶液中,可以大量共存的是( )
A.Al3+、Na+、SO42-、Br-B.Na+、NH4+、NO3-、I-
C.K+、Mg2+、Fe3+、Cl-D.Na+、AlO2-、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,气态分子断开1mol化学键的焓变称为键能.已知H﹣H、H﹣O和O=O键的键能△H分别为436kJ/mol、463kJ/mol和495kJ/mol,18g水蒸气变成液态水放出44kJ的热量,则氢气的燃烧热为( )
A.242.5kJmol﹣1
B.286.5kJmol﹣1
C.198.5kJmol﹣1
D.573kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用: 
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H>0 ( I)
①该反应的平衡常数表达式K=;
②若K=1,向某恒容密闭容器中加入1.0mol I2(g)和足量TaS2(s),则I2(g)的平衡转化率为 .
(2)如图所示,反应( I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是 .
(3)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢样中的硫转化为 H2SO3 , 然后用一定浓度的I2溶液进行滴定,所用指示剂为 , 滴定反应的离子方程式为 .
(4)25°C时,将a molL﹣1的氨水与b molL﹣1的盐酸等体积混合,所得溶液的pH=7,则c(NH4+)c(Cl﹣);ab.(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的一个原则是“原子经济”,最理想的“原子经济”是全部反应物的原子嵌入期望的产物中。在下列反应类型中,“原子经济”程度最低的是( )
A. 化合反应B. 取代反应C. 加成反应D. 加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( ) ①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl ④CHCl2﹣CHBr2 ⑤ ![]() ⑥CH2Cl2 .
⑥CH2Cl2 .
A.①③⑥
B.②③⑤
C.全部
D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com