
【题目】在化学反应A(g)+B(g)![]() 2C(g)+D(g) ΔH=Q kJ·mol-1 过程中的能量变化如图所示,回答下列问题。
2C(g)+D(g) ΔH=Q kJ·mol-1 过程中的能量变化如图所示,回答下列问题。

(1)Q________0(填“>”“<”或“=”)。
(2)熵变ΔS________0(填“>”“<”或“=”)。
(3)该反应________自发进行(填“能”或“不能”)。
(4)升高温度平衡常数K________(填“增大”“减小”或“不变”),平衡向________方向移动。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】二氯二氢硅(SiH2C12)常作于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl 与硅在250-260℃反应可以制得SiH2Cl2.
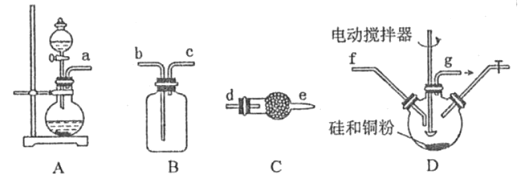
(1) 利用浓硫酸、浓盐酸为原料,选用A 装置制取HC1,利用了浓硫酸的_______性。
(2)D 装置中生成 二氯二氢硅的化学方程式为___________________。
(3) 按照气体从左到右方向,制取SiH2Cl2的装置连接次序为a→___→___→f→g→___→___→____→_____(填仪器接口的字母,其中装置C 用到2 次).其中装置B 的作用是____;前面装置C 中装的药品为______,后面装置C的作用为____________。
(4)新的制取SiH2Cl2 方法是: 往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl 在250-260℃反应,可以大大提高产率。如果通入气体次序相反,产率会降低,其原因是__________(用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法可行的是
A. 将乙醇和浓H2SO4混合液水浴加热制取乙烯 B. 用溴水除去苯中的苯酚
C. 用CCl4萃取溶解在溴苯中的溴单质 D. 用溴水除去乙烷中的乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,某化学反应2A![]() B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:

根据上述数据,回答以下问题:
(1)实验1中,10至30分钟时间内A的平均反应速率为________mol·L-1·min-1,达平衡时B物质的浓度为________,A的转化率为________。
(2)实验2中,隐含的反应条件可能是________。
(3)实验3中,A的起始的物质的量________(填“>”“<”或“=”)1.0 mol,实验3和实验1的起始速率v3________(填“>”“<”或“=”)v1,由实验1和实验5可确定上述反应为________(填“放热”或“吸热”) 反应,实验4中,该反应温度下其平衡常数为________。
(4)若开始时在实验2的密闭容器中充入1.0molB,1.0molD,达平衡时A物质的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
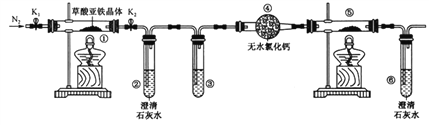
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为两套实验装置。

(1)写出下列仪器的名称:a:______。
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是______。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是______。除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有______。
②根据计算得知,需称量NaOH的质量为______g。
③配制时,其正确的操作顺序是______(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④下列操作使配制的NaOH溶液浓度偏低的有______。
A.称量氢氧化钠时间过长 B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.定容时俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com