
”¾ĢāÄæ”æµŖ(N)”¢Į×(P)”¢Éé(As)µČVA×åŌŖĖŲ»ÆŗĻĪļŌŚŃŠ¾æŗĶÉś²śÖŠÓŠÖŲŅŖÓĆĶ¾”£ČēĪŅ¹śæĘŃŠČĖŌ±ŃŠ¾æ·¢ĻÖAs2O3(»ņŠ“³ÉAs4O6£¬Ė׳ĘÅųĖŖ)¶Ō°×ŃŖ²”ÓŠĆ÷ĻŌµÄÖĪĮĘ×÷ÓĆ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AsŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ_________________£»PµÄµŚŅ»µēĄėÄܱČS“óµÄŌŅņĪŖ_______________
£Ø2£©Š“³öŅ»ÖÖÓėCN”„»„ĪŖµČµē×ÓĢåµÄĮ£×Ó________(ÓĆ»ÆѧŹ½±ķŹ¾)£»(SCN)2·Ö×ÓÖŠ¦Ņ¼üŗĶ¦Š¼üøöŹż±ČĪŖ___________
£Ø3£©ÅųĖŖ¾ē¶¾£¬æÉÓĆŹÆ»ŅĻū¶¾Éś³ÉAsO33-ŗĶÉŁĮæAsO43-£¬ĘäÖŠAsO33-ÖŠAsµÄŌӻƷ½Ź½ĪŖ__________£¬AsO43-µÄæռ乹ŠĶĪŖ___________
£Ø4£©NH4+ÖŠHŅ»NŅ»HµÄ¼ü½Ē±ČNH3ÖŠH Ņ»NŅ»HµÄ¼ü½Ē“óµÄŌŅņŹĒ__________£»NH3ŗĶĖ®·Ö×ÓÓėĶĄė×ÓŠĪ³ÉµÄ»ÆŗĻĪļÖŠŃōĄė×Ó³ŹÖįĻņĻĮ³¤µÄ°ĖĆęĢå½į¹¹(ČēĻĀĶ¼I)£¬øĆ»ÆŗĻĪļ¼ÓČČŹ±Ź×ĻČŹ§Č„Ė®£¬Ēė“ÓŌ×Ó½į¹¹½Ē¶Č¼ÓŅŌ·ÖĪö£ŗ__________
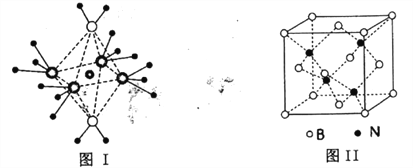
£Ø5£©BNµÄČŪµćĪŖ3000”ę£¬ĆܶČĪŖ2.25g”¤cm-3£¬Ę侧°ū½į¹¹ČēÉĻĶ¼¢ņĖłŹ¾£¬¾§ĢåÖŠŅ»øöBŌ×ÓÖÜĪ§¾ąĄė×ī½üµÄNŌ×ÓÓŠ__________øö£»ČōŌ×Ó°ė¾¶·Ö±šĪŖrNpmŗĶrBpm£¬°¢·ü¼ÓµĀĀŽ³£ŹżÖµĪŖNA£¬ŌņBN¾§°ūÖŠŌ×ÓµÄĢå»żÕ¼¾§°ūĢå»żµÄ°Ł·ÖĀŹĪŖ__________
”¾“š°ø”æ 1s22s22p63s23p63d104s24p3»ņ[Ar]3d104s24p3 PµÄpÄܼ¶ŹĒ°ė³äĀś×“Ģ¬£¬±Č½ĻĪČ¶Ø£¬ĖłŅŌµŚŅ»µēĄėÄܱČĮņ“ó CO»ņN2 5:4 sp3 ÕżĖÄĆęĢå NH4+ÖŠµÄµŖŌ×ÓÉĻ¾łĪŖ³É¼üµē×Ó£¬¶ųNH3·Ö×ÓÖŠµÄµŖŌ×ÓÉĻÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬¹Ā¶Ōµē×ÓÓė³É¼üµē×ÓÖ®¼äµÄÅųāĮ¦ĒæÓŚ³É¼üµē×ÓÓė³É¼üµē×ÓÖ®¼äµÄÅųāĮ¦£¬µ¼ÖĀNH4+ÖŠH-N-HµÄ¼ü½Ē±ČNH3ÖŠ“ó ÓÉÓŚOŌ×Ó°ė¾¶Š”£¬µēøŗŠŌ“ó£¬Ģį¹©¹Ā¶Ōµē×ÓÄÜĮ¦±ČNŌ×ÓČõ£¬¹ŹĖ®·Ö×ÓŠĪ³ÉµÄÅäĪ»¼üČõÓŚ°±·Ö×Ó 4 ![]()
”¾½āĪö”æŹŌĢā·ÖĪö£ŗ±¾Ģāæ¼²éŌ×ÓŗĖĶāµē×ÓÅŲ¼Ź½µÄŹéŠ“£¬µŚŅ»µēĄėÄÜµÄ±Č½Ļ£¬µČµē×ÓĢ壬¦Ņ¼üŗĶ¦Š¼üµÄÅŠ¶Ļ£¬ŌӻƷ½Ź½ŗĶæռ乹ŠĶµÄÅŠ¶Ļ£¬¾§ĢåµÄ·ÖĪöŗĶ¼ĘĖć”£
£Ø1£©AsŌ×ÓŗĖĶāÓŠ33øöµē×Ó£¬øł¾Ż¹¹ŌģŌĄķ£¬AsŌ×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ1s22s22p63s23p63d104s24p3»ņ[Ar] 3d104s24p3”£PŗĶS¶¼“¦ÓŚµŚČżÖÜĘŚ£¬SµÄ¼Ūµē×ÓÅŲ¼Ź½ĪŖ3s23p4£¬PµÄ¼Ūµē×ÓÅŲ¼Ź½ĪŖ3s23p3£¬PµÄ3pÄܼ¶“¦ÓŚ°ė³äĀś£¬±Č½ĻĪČ¶Ø£¬PµÄµŚŅ»µēĄėÄܱČSµÄ“ó”£
£Ø2£©ÓĆ”°Ģę“ś·Ø”±£¬ÓėCN-»„ĪŖµČµē×ÓĢåµÄĮ£×ÓÓŠCO”¢N2”¢C22-µČ”££ØSCN£©2µÄ½į¹¹Ź½ĪŖN![]() C”ŖS”ŖS”ŖC
C”ŖS”ŖS”ŖC![]() N£¬µ„¼üČ«ŹĒ¦Ņ¼ü£¬Čż¼üÖŠÓŠ1øö¦Ņ¼üŗĶ2øö¦Š¼ü£¬£ØSCN£©2·Ö×ÓÖŠÓŠ5øö¦Ņ¼ü”¢4øö¦Š¼ü£¬¦Ņ¼üŗĶ¦Š¼üøöŹż±ČĪŖ5:4”£
N£¬µ„¼üČ«ŹĒ¦Ņ¼ü£¬Čż¼üÖŠÓŠ1øö¦Ņ¼üŗĶ2øö¦Š¼ü£¬£ØSCN£©2·Ö×ÓÖŠÓŠ5øö¦Ņ¼ü”¢4øö¦Š¼ü£¬¦Ņ¼üŗĶ¦Š¼üøöŹż±ČĪŖ5:4”£
£Ø3£©AsO33-ÖŠAsÉĻµÄ¹Āµē×Ó¶ŌŹż=![]() £Ø5+3-3
£Ø5+3-3![]() 2£©=1£¬³É¼üµē×Ó¶ŌŹżĪŖ3£¬AsµÄ¼Ū²ćµē×Ó¶ŌŹżĪŖ1+3=4£¬AsµÄŌӻƷ½Ź½ĪŖsp3ŌӻƔ£AsO43-ÖŠAsÉĻµÄ¹Āµē×Ó¶ŌŹż=
2£©=1£¬³É¼üµē×Ó¶ŌŹżĪŖ3£¬AsµÄ¼Ū²ćµē×Ó¶ŌŹżĪŖ1+3=4£¬AsµÄŌӻƷ½Ź½ĪŖsp3ŌӻƔ£AsO43-ÖŠAsÉĻµÄ¹Āµē×Ó¶ŌŹż=![]() £Ø5+3-4
£Ø5+3-4![]() 2£©=0£¬³É¼üµē×Ó¶ŌŹżĪŖ4£¬AsµÄ¼Ū²ćµē×Ó¶ŌŹżĪŖ0+4=4£¬AsO43-µÄVSEPRÄ£ŠĶĪŖÕżĖÄĆęĢ壬ÓÉӌƻӊ¹Āµē×Ó¶Ō£¬AsO43-µÄæռ乹ŠĶĪŖÕżĖÄĆęĢ唣
2£©=0£¬³É¼üµē×Ó¶ŌŹżĪŖ4£¬AsµÄ¼Ū²ćµē×Ó¶ŌŹżĪŖ0+4=4£¬AsO43-µÄVSEPRÄ£ŠĶĪŖÕżĖÄĆęĢ壬ÓÉӌƻӊ¹Āµē×Ó¶Ō£¬AsO43-µÄæռ乹ŠĶĪŖÕżĖÄĆęĢ唣
£Ø4£©NH4+ÖŠH”ŖN”ŖHµÄ¼ü½Ē±ČNH3ÖŠH”ŖN”ŖHµÄ¼ü½Ē“óµÄŌŅņŹĒ£ŗNH4+ÖŠµÄµŖŌ×ÓÉĻ¾łĪŖ³É¼üµē×Ó£¬¶ųNH3·Ö×ÓÖŠµÄµŖŌ×ÓÉĻÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬¹Ā¶Ōµē×ÓÓė³É¼üµē×ÓÖ®¼äµÄÅųāĮ¦ĒæÓŚ³É¼üµē×ÓÓė³É¼üµē×ÓÖ®¼äµÄÅųāĮ¦£¬µ¼ÖĀNH4+ÖŠH-N-HµÄ¼ü½Ē±ČNH3ÖŠ“ó”£NH3ŗĶĖ®·Ö×ÓÓėĶĄė×ÓŠĪ³ÉµÄ»ÆŗĻĪļÖŠŃōĄė×Ó³ŹÖįĻņĻĮ³¤µÄ°ĖĆęĢå½į¹¹£¬øĆ»ÆŗĻĪļ¼ÓČČŹ±Ź×ĻČŹ§Č„Ė®£¬ĖµĆ÷Ė®·Ö×ÓÓėCu2+ŠĪ³ÉµÄÅäĪ»¼üČõÓŚNH3·Ö×Ó£¬ŌŅņŹĒ£ŗOŌ×Ó°ė¾¶Š”£¬µēøŗŠŌ“ó£¬Ģį¹©¹Ā¶Ōµē×ÓÄÜĮ¦±ČNŌ×ÓČõ£¬¹ŹĖ®·Ö×ÓÓėCu2+ŠĪ³ÉµÄÅäĪ»¼üČõÓŚ°±·Ö×Ó”£
£Ø5£©ÓĆ”°¾łĢÆ·Ø”±£¬B£ŗ8![]() +6
+6![]() =4£¬N£ŗ4£¬øĆ¾§ĢåµÄ»ÆѧŹ½ĪŖBN£¬øł¾Ż¾§°ū£¬¾§ĢåÖŠŅ»øöNŌ×ÓÖÜĪ§¾ąĄė×ī½üµÄBŌ×ÓÓŠ4øö£¬ŌņŅ»øöBŌ×ÓÖÜĪ§¾ąĄė×ī½üµÄNŌ×ÓÓŠ4øö”£Ņ»øö¾§°ūÖŠŌ×ÓµÄĢå»żĪŖ4
=4£¬N£ŗ4£¬øĆ¾§ĢåµÄ»ÆѧŹ½ĪŖBN£¬øł¾Ż¾§°ū£¬¾§ĢåÖŠŅ»øöNŌ×ÓÖÜĪ§¾ąĄė×ī½üµÄBŌ×ÓÓŠ4øö£¬ŌņŅ»øöBŌ×ÓÖÜĪ§¾ąĄė×ī½üµÄNŌ×ÓÓŠ4øö”£Ņ»øö¾§°ūÖŠŌ×ÓµÄĢå»żĪŖ4![]() £Ø
£Ø![]() ¦ŠrN3+
¦ŠrN3+![]() ¦ŠrB3£©pm3=4
¦ŠrB3£©pm3=4![]() £Ø
£Ø![]() ¦ŠrN3+
¦ŠrN3+![]() ¦ŠrB3£©
¦ŠrB3£©![]() 10-30cm3£¬1mol¾§ĢåµÄÖŹĮæĪŖ25g£¬1mol¾§ĢåµÄĢå»żĪŖ25g
10-30cm3£¬1mol¾§ĢåµÄÖŹĮæĪŖ25g£¬1mol¾§ĢåµÄĢå»żĪŖ25g![]() 2.25g/cm3£¬¾§°ūµÄĢå»żĪŖ4
2.25g/cm3£¬¾§°ūµÄĢå»żĪŖ4![]() £Ø25g
£Ø25g![]() 2.25g/cm3
2.25g/cm3![]() NA£©£¬BN¾§°ūÖŠŌ×ÓµÄĢå»żÕ¼¾§°ūĢå»żµÄ°Ł·ÖĀŹĪŖ4
NA£©£¬BN¾§°ūÖŠŌ×ÓµÄĢå»żÕ¼¾§°ūĢå»żµÄ°Ł·ÖĀŹĪŖ4![]() £Ø
£Ø![]() ¦ŠrN3+
¦ŠrN3+![]() ¦ŠrB3£©
¦ŠrB3£©![]() 10-30cm3
10-30cm3![]() [4
[4![]() £Ø25g
£Ø25g![]() 2.25g/cm3
2.25g/cm3![]() NA£©]=
NA£©]=![]() ”£
ӣ


 ĶسĒѧµäĬŠ“ÄÜŹÖĻµĮŠ“š°ø
ĶسĒѧµäĬŠ“ÄÜŹÖĻµĮŠ“š°ø ½šÅĘ½ĢøØÅąÓÅÓÅŃ”¾ķĘŚÄ©³å“Ģ100·ÖĻµĮŠ“š°ø
½šÅĘ½ĢøØÅąÓÅÓÅŃ”¾ķĘŚÄ©³å“Ģ100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ŹĒ²æ·Ö¶ĢÖÜĘŚŌŖĖŲŌ×Ó£ØÓĆ×ÖÄø±ķŹ¾£©×īĶā²ćµē×ÓŹżÓėŌ×ÓŠņŹżµÄ¹ŲĻµĶ¼”£
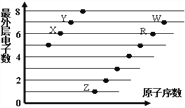
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ĘųĢ¬Ēā»ÆĪļ·Šµć£ŗX£¾Y£¾R
B. Ąė×Ó°ė¾¶£ŗR£¾X£¾Y£¾Z
C. ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗY£¾X£¾W£¾R
D. X”¢ZŠĪ³ÉµÄ»ÆŗĻĪļÖŠÖ»ÓŠĄė×Ó¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
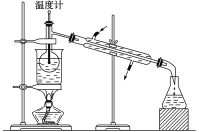
”¾ĢāÄæ”æČēĶ¼ŹĒ֊ѧ»Æѧ֊³£ÓĆÓŚ»ģŗĻĪļµÄ·ÖĄėŗĶĢį“æµÄ×°ÖĆ,Ēėøł¾Ż×°ÖĆ»Ų“šĪŹĢā:
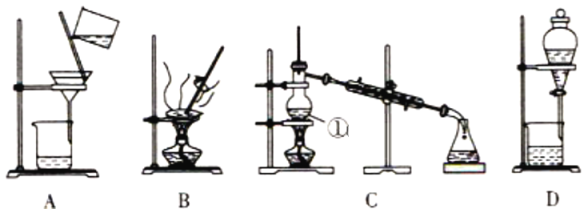
£Ø1£©ŌŚ×°ÖĆAŗĶ×°ÖĆBÖŠ¶¼ÓƵ½²£Į§°ō,×°ÖĆAÖŠ²£Į§°ōµÄ×÷ÓĆŹĒ__________,×°ÖĆBÖŠ²£Į§°ōµÄ×÷ÓĆŹĒ__________,·ĄÖ¹Õō·¢ĆóÄŚČÜŅŗŅņ¾Ö²æ¹żČȶų½¦³ö”£
£Ø2£©×°ÖĆCÖŠ¢ŁµÄĆū³ĘŹĒ__________,¢ŁÖŠ¼ÓČė·ŠŹÆµÄ×÷ÓĆŹĒ__________,ĄäČ“Ė®µÄ·½ĻņŹĒ__________”£×°ÖĆDŌŚ·ÖŅŗŹ±ĪŖŹ¹ŅŗĢåĖ³ĄūµĪĻĀ,Ó¦½ųŠŠµÄ¾ßĢå²Ł×÷ŹĒ__________”£
£Ø3£©“ÓĀČ»ÆÄĘČÜŅŗÖŠµĆµ½ĀČ»ÆÄĘ¹ĢĢå,Ń”Ōń×°ÖĆ__________(Ģī“ś±ķ×°ÖĆĶ¼µÄ×ÖÄø,ĻĀĶ¬);³żČ„×ŌĄ“Ė®ÖŠµÄCl-µČŌÓÖŹ,Ń”Ōń×°ÖĆ__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷”¢ŹµŃéĻÖĻóŗĶŹµŃé½įĀŪ¾łÕżČ·µÄŹĒ
Ń”Ļī | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó | ŹµŃé½įĀŪ |
A | ĻņŅ»¶ØÅضČCuSO4ČÜŅŗÖŠĶØČėH2SĘųĢå | ³öĻÖŗŚÉ«³Įµķ | H2SĖįŠŌ±ČH2SO4Ēæ |
B | ³£ĪĀĻĀ£¬ĻąĶ¬ĀĮʬ·Ö±šĶ¶Čė×ćĮæĻ””¢ÅØĮņĖįÖŠ | ÅØĮņĖįÖŠĀĮʬĻČČܽāĶź | ·“Ó¦ĪļÅضČŌ½“󣬷“Ó¦ĖŁĀŹŌ½“ó |
C | 2mL0.1mol”¤L-1MgCl2ČÜŅŗÖŠµĪ¼Ó2µĪ1mol”¤L-1NaOHČÜŅŗ£¬ŌŁµĪ¼Ó2µĪ0.1mol”¤L-1FeCl3ČÜŅŗ | ĻČÉś³É°×É«³Įµķ£¬ŗóÉś³ÉŗģŗÖÉ«³Įµķ | Ksp[Mg(OH)2]>|Ksp[Fe(OH)3] |
D | Ļņ2mL2%CuSO4ČÜŅŗÖŠ¼ÓČė¼øµĪ1%NaOHČÜŅŗ£¬Õńµ“ŗó¼ÓČė¼øµĪÓŠ»śĪļ¢śČÜŅŗ£¬¼ÓČČ | Ī“³öĻÖשŗģÉ«³Įµķ | ¢ś²»æÉÄÜŹĒĘĻĢŃĢĒ |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ168OµÄŠšŹöÕżČ·µÄŹĒ
A. ÖŹĮæŹżĪŖ8 B. ÖŹ×ÓŹżĪŖ16 C. ÖŠ×ÓŹżĪŖ8 D. µē×ÓŹżĪŖ16
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃé·ØŹĒѧĻ°»ÆѧµÄÖŲŅŖ·½·Ø”£
¢ń£®ŗ£“ųÖŠŗ¬ÓŠ·įø»µÄµāŌŖĖŲ£¬ŅŌµāĄė×ӵĊĪŹ½“ęŌŚ”£ŹµŃéŹŅĄļ“Óŗ£ŌåÖŠĢįČ”µāµÄĮ÷³ĢČēĻĀ(ŅŃÖŖ2I-£«Cl2=2Cl-£«I2£¬µāÓėäåŅ»ŃłŅ×ČÜÓŚÓŠ»śČܼĮ)£ŗ
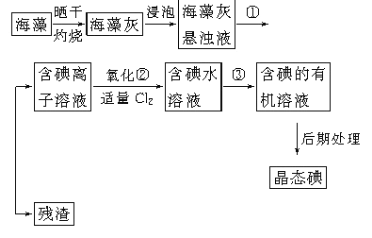
£Ø1£©ŹµŃé²Ł×÷¢ŁµÄĆū³Ę£ŗ___________________ ”£
£Ø2£©ŹµŃé²½Öč¢ŚÖŠ¼ÓŹŹĮæCl2µÄÄæµÄŹĒ______________________________”£
£Ø3£©ŹµŃé²½Öč¢ŪĢįČ”µāµÄ¹ż³ĢÖŠ£¬²»ÄÜŃ”ÓƵÄČܼĮŹĒ________”£
A£®±½ B£®¾Ę¾« C£®ĖÄĀČ»ÆĢ¼
£Ø4£©“Óŗ£ŌåæŖŹ¼¾¹ż5²½²Ł×÷µ½ŗ¬µāµÄÓŠ»śČÜŅŗµÄŹµŃé¹ż³ĢÖŠ£¬ŅŖÓƵ½¶ąÖÖŹµŃéŅĒĘ÷”£ŅŃÖŖŹµŃéŹŅĄļÓŠŪįŪö”¢ŪįŪöĒÆ”¢ÉÕ±”¢²£Į§°ō”¢¾Ę¾«µĘ”¢ŹÆĆŽĶų”¢ŅŌ¼°±ŲŅŖµÄ¼Š³ÖŅĒĘ÷µČĪļĘ·£¬ÉŠČ±ÉŁµÄ²£Į§ŅĒĘ÷ŹĒ__________________”¢________________”£
£Ø5£©“Óŗ¬µāµÄÓŠ»śČÜŅŗÖŠĢįČ”µāŗĶ»ŲŹÕÓŠ»śČܼĮ£¬»¹Šč¾¹żÕōĮó£¬Öø³öĻĀĶ¼ĖłŹ¾ŹµŃé×°ÖĆÖŠµÄ“ķĪóÖ®“¦£ŗ_________________”¢_________________”¢__________________”£
¢ņ£®Ä³Ń§ÉśÉč¼ĘĮĖČēĻĀŹµŃé·½·Ø·ÖĄėNaClŗĶCaCl2Į½ÖÖ¹ĢĢå»ģŗĻĪļ:
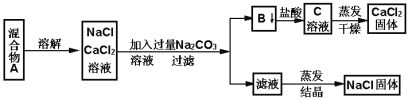
ĢīæÕŗĶ»Ų“šĻĀĮŠĪŹĢā
£Ø1£©Š“³öÉś³ÉBĪļÖŹµÄ»Æѧ·½³ĢŹ½________________
£Ø2£©ĀĖŅŗÖŠµÄČÜÖŹÓŠ_____________________£ØŠ“»ÆѧŹ½£©£¬ČōŅŖÖĘµĆ“æ¾»µÄNaCl£¬Ó¦ĻņĀĖŅŗÖŠ¼ÓČėŹŹĮæµÄijÖÖŹŌ¼Į£¬øĆŹŌ¼ĮµÄĆū³ĘŹĒ_________________ ”£
£Ø3£©ČōŅŖ²ā¶ØøĆѳʷ֊NaClŗĶCaCl2µÄÖŹĮæ±Č£¬æɳĘĮæøÉŌļµÄBĪļÖŹŗĶĮķŅ»ĪļÖŹµÄÖŹĮ棬ÕāÖÖĪļÖŹŹĒ___________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©0.1L K2SO4ŗĶMgSO4µÄ»ģŗĻČÜŅŗÖŠ£¬ŗ¬Mg2+ 2.4g£¬SO42©µÄĪļÖŹµÄĮæÅضČĪŖ1.5mol/L£¬ĒóMgSO4ŗĶK2SO4µÄĪļÖŹµÄĮæÅØ¶Č£æ_____________
£Ø2£©³£ĪĀĻĀ£¬½«20.0gÖŹĮæ·ÖŹżĪŖ14.0%µÄKNO3ČÜŅŗÓė30.0gÖŹĮæ·ÖŹżĪŖ24.0%µÄKNO3ČÜŅŗ»ģŗĻ£¬µĆµ½µÄĆܶČĪŖ1.15g/cm3µÄ»ģŗĻČÜŅŗ£®¼ĘĖć£ŗ
¢Ł»ģŗĻŗóČÜŅŗµÄÖŹĮæ·ÖŹż£®_________
¢Ś»ģŗĻŗóČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č£®________
¢ŪŌŚ1000gĖ®ÖŠŠčČܽā¶ąÉŁÄ¦¶ūKNO3²ÅÄÜŹ¹ĘäÅضČĒ”ŗĆÓėÉĻŹö»ģŗĻŗóČÜŅŗµÄÅضČĻąµČ£æ_____________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶųĖŁÓ°ĻģĶųÉĻŹŚæĪŠ§¹ū£¬ĻĀĮŠĪļÖŹæÉŅŌÓĆĄ“Éś²ś¹āµ¼ĻĖĪ¬µÄŹĒ
A.ĢÕ“ÉB.¶žŃõ»Æ¹čC.ŹÆÄ«Ļ©D.²£Į§
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¶ŌĢžµÄŠšŹöÕżČ·µÄŹĒ
A.Ö»ÓŠĶéĢž·Ö×ÓÖŠ²Å“ęŌŚĢ¼Ģ¼µ„¼üB.ĖłÓŠµÄĢž¶¼æÉŅŌČ¼ÉÕ
C.·Ö×ÓĶØŹ½ĪŖCnH2n+2µÄĢžæÉÄÜŹĒĶéĢž£¬Ņ²æÉÄÜŹĒĻ©ĢžD.³żĻ©ĢžĶā£¬ĘäĖūĢž¶¼²»ÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com