
| A. | 一样大 | B. | 后者大 | C. | 前者大 | D. | 无法确定 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 坩埚质量 | 坩埚+试样 | 失水后,坩埚+试样 |
| 11.70g | 20.82g | 16.50g |
| A. | 晶体中含不挥发杂质 | B. | 未做恒重操作 | ||
| C. | 加热前晶体未研磨 | D. | 加热时有晶体溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
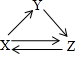 X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化).下列各组物质中,不能满足此转化关系的是( )
X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化).下列各组物质中,不能满足此转化关系的是( )| 物质 选项 | X | Y | Z |
| A | Al | Al2O3 | Na[Al(OH)4](或NaAlO2) |
| B | Fe | FeCl3 | FeCl2 |
| C | C | CO | CO2 |
| D | Cl2 | HCl | NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某中性溶液中:Fe3+、Na+、SO42-、Cl- | |
| B. | 1.2mol•L-1的NaNO3溶液:Fe2+、H+、Cl-、SO42-、 | |
| C. | 0.1 mol•L-1的NH4HCO3溶液:Na+、K+、NO3-、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:NO3-、HCO3-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将铝片放入浓H2SO4中 | 生成刺激性气味气体 | Al在常温下与浓H2SO4反应生成SO2 |
| B | 向AlCl3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 | 溶液先不显红色,加入氯水后变红色 | 该溶液中含有Fe3+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中含有I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com