
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
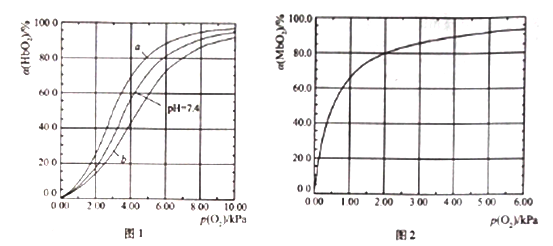
HbO2(aq)+H+(aq) ![]() HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为______ (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) ![]() MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为____________。
(4)图2中a随p(O2)增大而增大的原因是______________。
(5) Mb与氧气结合的平衡常数的表达式K=![]() ,计算37℃时K=____________。
,计算37℃时K=____________。
(6) Mb与氧气结合达平衡时结合度a=____________ [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为____________。
【答案】 a 氧气分压高,使反应①平衡向逆反应方向移动,c( H+) 增大,导致反应②平衡向逆反应方向移动,释放出更多的CO2 ![]() mol/(Lmin) 反应③正反应是气体体积缩小的反应,p(O2)增大,平衡向正反应方向移动 2.00 kPa-1
mol/(Lmin) 反应③正反应是气体体积缩小的反应,p(O2)增大,平衡向正反应方向移动 2.00 kPa-1 ![]() 97.6%
97.6%
【解析】(1)考查影响化学平衡的因素,pH越大,c(H+)越小,平衡向逆反应方向进行,与氧气的结合度越大,即a曲线是pH=7.6;(2)考查影响化学平衡的因素,氧气分压高,使平衡①向逆反应方向进行,增加与氧气的结合度,c(H+)增大,促使反应②向逆反应方向进行,因此有利于CO2排出体外;(3)考查化学反应速率的计算,结合度达到50%,说明生成的MbO2的浓度为c0×50%mol·L-1, v(MbO2)=c0/2tmol/(L·min);(4)考查影响化学平衡的移动,根据反应③的方程式,反应物的气体系数之和大于生成物的气体系数之和,增大压强,平衡向正反应方向移动;(5)本题考查化学平衡常数的计算,当p(O2)=2kPa,此时的结合度为80%,即c(MbO2)=c×80%mol·L-1,c(Mb)=c×20%mol·L-1,代入表达式,K=c×80%/(c×20%×2)=2.00kPa-1;(6)本题考查化学平衡常数的计算,根据(5)中化学平衡常数的表达式,有K=c(Mb)×a/[c(Mb)×(1-a)×p(O2)],解得a=![]() ,K只受温度的影响,温度不变,则K不变,因此K=2,p(O2)=20,代入上述表达式,即a=97.6%。
,K只受温度的影响,温度不变,则K不变,因此K=2,p(O2)=20,代入上述表达式,即a=97.6%。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
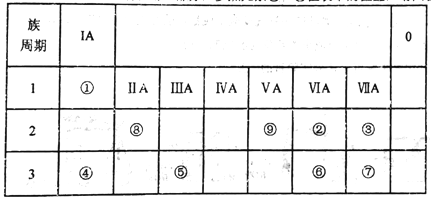
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
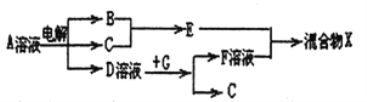
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是
A. 生石灰、白磷、熟石灰 B. 空气、氮气、胆矾
C. 干冰、铁、氯化氢 D. 烧碱、水银、碘酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在第二次世界大战中拯救了成千上万士兵的生命,被誉为与原子弹、雷达齐名的当时三大发明之一的药物是( )
A.青霉素
B.阿司匹林
C.麻黄碱
D.抗酸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A. 一定条件下反应I2+H2![]() 2HI中,H2的转化率不能达到100%
2HI中,H2的转化率不能达到100%
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状碳酸钙反应要快
D. 反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达平衡后,升高温度反应速率加快
2NH3(g) △H<0达平衡后,升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用氢氧化钠溶液吸收NO2 :2OH- + 2NO2=NO2-+ NO3-+ H2O
B. 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
C. 向NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O=2Al(OH)3↓ + CO32-
D. 向明矾溶液中滴加氢氧化钡溶液,使SO42-恰好沉淀完全Al3++ 2SO42-+ 2Ba2++ 4OH-= 2BaSO4↓+ AlO2-+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硅元素的单质及其化合物是构成自然界的重要物质.
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:
CH3COONa+NaOH ![]() CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于晶体(填晶体类型);
②MgO晶体的熔点比CaO高,主要原因是 .
(2)C60、金刚石和石墨是三种重要的碳单质,结构模型分别如图所示(其中石墨仅表示出其中的一层结构). 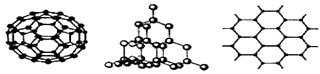
①金刚石中碳原子的杂化方式为;
②石墨层状结构中,平均每个正六边形占有的C﹣C键数是个.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com