
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
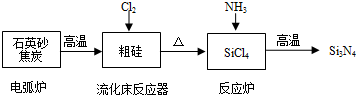
分析 (1)①石英砂主要成分为二氧化硅,二氧化硅和碳在高温的条件下反应生成粗硅和一氧化碳;
②用石英砂和焦炭在电弧炉中高温加热生成碳化硅和一氧化碳,具有金刚石结构的碳化硅俗称金刚砂;
(2)分析数据,结合蒸馏原理分析控制沸点分离物质,所以提纯SiCl4的主要工艺操作依次是沉降、冷凝;
(3)①Si3N4遇水水解,生成常用于做制冷剂的气体为氨气,一种难溶性的酸为硅酸,据此书写;
②有元素的化合价变化的反应一定为氧化还原反应结合该合成氨化硅工艺流程中涉及的主要反应分析.
解答 解:(1)①二氧化硅与碳在高温条件下反应生成硅和一氧化碳,化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑;
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑;
②石英砂的主要成分是二氧化硅,在反应中生成碳化硅,反应为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅俗称金刚砂,属于原子晶体,其晶体结构与金刚石相似,
故答案为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;金刚砂;金刚石;
(2)在流化床反应的产物中,SiCl4大约占85%,Si+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2,还有Cl2等,利用沸点的不同提纯SiCl4属于蒸馏,SiCl4(沸点57.6℃)中含有少量SiHCl3(沸点33.0℃)和HCl(沸点-84.7℃)和Cl2(沸点-34.1℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质,所以提纯SiCl4的主要工艺操作依次是沉降、冷凝,依据图表数据分析可知,温度应控制在略小于57.6℃,
故答案为:蒸馏;C;
(3)①Si3N4遇水水解,生成常用于做制冷剂的气体为氨气,一种难溶性的酸为硅酸,反应为:Si3N4+9H2O=4NH3↑+3H2SiO3↓,
故答案为:Si3N4+9H2O=4NH3↑+3H2SiO3↓;
②该合成氨化硅工艺流程中发生的主要反应是:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑(氧化还原反应),Si+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4(氧化还原反应),3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl(非氧化还原反应),
故答案为:2.
点评 本题考查了实验方案设计的有关知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分 子质量 | 密度 (g•cm-3) | 沸点 ℃ | 溶解性 | |
| 环己 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空.说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 有机垃圾发酵生产沼气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com