

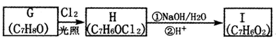
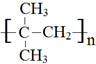 .
. .
.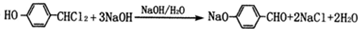 .
. .
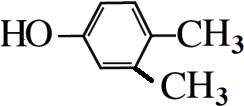
. 分析 A的分子式为C4H9Cl,A的核磁共振氢谱只有一种氢,则A为(CH3)3CCl,A在氢氧化钠醇溶液、加热条件下发生消去反应生成B为CH2=C(CH3)2,B发生信息2中的反应生成C为(CH3)2CHCH2OH,C发生催化氧化生成D为(CH3)2CHCHO,D再与氢氧化铜反应、酸化得到E为(CH3)2CHCOOH.G的分子式为C7H8O,G中有个数比为l:2:2:3的四种氢,且G遇 FeCl3溶液显紫色,则G为 ,与氯气在光照条件下发生取代反应生成H为
,与氯气在光照条件下发生取代反应生成H为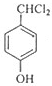 ,H在氢氧化钠水溶液发生水解反应,酸化得到I,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故I为
,H在氢氧化钠水溶液发生水解反应,酸化得到I,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故I为 .
.
解答 解:A的分子式为C4H9Cl,A的核磁共振氢谱只有一种氢,则A为(CH3)3CCl,A在氢氧化钠醇溶液、加热条件下发生消去反应生成B为CH2=C(CH3)2,B发生信息2中的反应生成C为(CH3)2CHCH2OH,C发生催化氧化生成D为(CH3)2CHCHO,D再与氢氧化铜反应、酸化得到E为(CH3)2CHCOOH.G的分子式为C7H8O,G中有个数比为l:2:2:3的四种氢,且G遇 FeCl3溶液显紫色,则G为 ,与氯气在光照条件下发生取代反应生成H为
,与氯气在光照条件下发生取代反应生成H为 ,H在氢氧化钠水溶液发生水解反应,酸化得到I,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故I为
,H在氢氧化钠水溶液发生水解反应,酸化得到I,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故I为 .
.
(1)A→B的反应类型为消去反应,B在一定条件下生成高聚物的结构简式为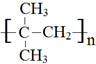 ,故答案为:消去反应;
,故答案为:消去反应;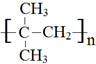 ;
;
(2)B为CH2=C(CH3)2,B分子中的碳原子处于同一平面内,故答案为:是;
(3)D为(CH3)2CHCHO,所含的官能团的名称是醛基,E为(CH3)2CHCOOH,用系统命名法命名:2-甲基丙酸,故答案为:醛基;2-甲基丙酸;
(4)G为 ,分子式为C8H10O且与G互为同系物的同分异构体,即有酚羟基的同分异构体,苯环上连有-OH、-CH2CH3,有邻间对三种,或-OH、-CH3、-CH3,2个甲基处于邻位,-OH有2种位置,2个甲基处于间位,-OH有4种位置,2个甲基处于对位,-OH有1种位置,所以共有9种,其中一种的结构简式为
,分子式为C8H10O且与G互为同系物的同分异构体,即有酚羟基的同分异构体,苯环上连有-OH、-CH2CH3,有邻间对三种,或-OH、-CH3、-CH3,2个甲基处于邻位,-OH有2种位置,2个甲基处于间位,-OH有4种位置,2个甲基处于对位,-OH有1种位置,所以共有9种,其中一种的结构简式为 等,
等,
故答案为:9; ;
;
(5)由H→I的第一步反应的化学方程式: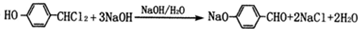 ,
,
故答案为: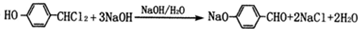 ;
;
(6)以甲苯为原料制备苯甲酸的合成路线: ,
,
故答案为: .
.
点评 本题考查有机物推断,注意根据反应条件与分子式进行推断,熟练掌握官能团的性质与转化,需要对给予的信息进行利用,能较好地考查学生阅读能力、自学能力,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
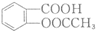 和
和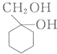 的流程路线.
的流程路线.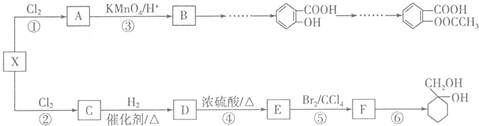
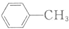 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$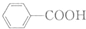
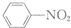 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$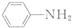 (苯胺,易被氧化)
(苯胺,易被氧化)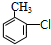 .
.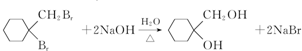 .
.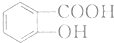 有多种同分异构体,写出符合下列条件的同分异构体的结构简式
有多种同分异构体,写出符合下列条件的同分异构体的结构简式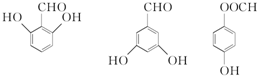 (任写一种).
(任写一种).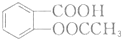 的结构与性质,说法正确的是AD.
的结构与性质,说法正确的是AD.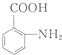 最合理的方案,请在答题纸的方框中表示.
最合理的方案,请在答题纸的方框中表示.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的N2和CO | B. | 同密度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同温度、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

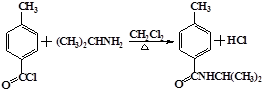 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是
东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿乃中药,宜采取水煎煮熬汁的方法服用 | |
| C. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取 | |
| D. | 青蒿素分子中有2种非极性键和3种极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 | |
| B. | H2O在4000℃以上开始明显分解,H2S用酒精灯加热即可完全分解 | |
| C. | 氯与钠形成离子键,氯与硅形成共价键 | |
| D. | “NO2球”在冷水中颜色变浅,在热水中颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为
A.X3Y B.XY3 C.XY2 D.X2Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com