
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
分析 该温度下水的离子积为Kw=1×10-12,酸和碱混合,若所得混合液的pH=2,则酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$计算,列式计算pH.可计算体积比.
解答 解:该温度下水的离子积为Kw=1×10-12,将pH=11的苛性钠中氢氧根离子浓度为:c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-11}}$mol/L=0.1mol/L,pH=1的稀硫酸中氢离子浓度为0.1mol/L,
pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V2-0.1mol/L×V1=0.01mol/L×(V1+V2),
整理可得:V1:V2=9:11;
pH=11的NaOH溶液的物质的量浓度为0.1mol/L,设体积为9L,故反应NaOH的物质的量为0.9mol,故溶液中钠离子为0.9mol;
pH=1的硫酸溶液的浓度为0.05mol/L,设体积为11L,故反应后溶液中硫酸根的物质的量为0.55mol;
由于反应后溶液的pH=2,故氢离子浓度为0.01mol/L,而溶液体积为20L,故氢离子的物质的量为0.2mol.
由于溶液显酸性,故溶液中的氢氧根的物质的量最小.据此可知,溶液中的离子浓度大小关系为:c(Na+)>c(SO42-)>c(H+)>c(OH-).
故答案为:9:11;c(Na+)>c(SO42-)>c(H+)>c(OH-).
点评 本题考查了混合溶液中的离子浓度的计算和离子浓度大小比较,难度不大,应注意的是氢氧化钠和硫酸中和时,钠离子和硫酸根未参与反应,故物质的量一直不变.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的少量O2:通过灼热的铜网,收集气体 | |
| B. | 除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体 | |
| C. | 除去FeCl3溶液中的少量FeCl2:加入足量铁屑,充分反应后过滤 | |
| D. | 除去NaCl溶液中的少量AlCl3:加入适量氨水,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
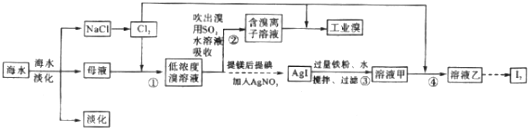
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na.Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | 原子半径:F<Mg<K | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色化学”的理念是从源头上减少和消除工业产生对环境的污染 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含有0.6mol Ca2+ | B. | 含有0.3mol Cl- | ||
| C. | n(Na+):n(OH-)=1:5 | D. | 所含元素中钙元素的质量很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成的 | |
| B. | 不同元素原子的质量数一定不等 | |
| C. | 质子数决定元素种类,质子数和中子数决定原子种类 | |
| D. | 质子数相同的粒子,其核外电子数一定相同,但化学性质不一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com