
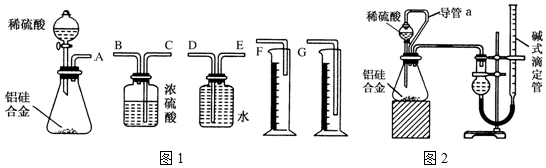
分析 (1)①装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部;
②根据镁、铝与稀硫酸反应放热且生成气体使锥形瓶中气体压强变大分析;
③保持分液漏斗内气体压强与锥形瓶内气体压强相等是读取示数的关键点,必须满足量筒中的液面与广口瓶的液面相平,读数时一定要平视读数;
(2)①导管a能够使锥形瓶和分液漏斗中的压强相等,据此分析对稀硫酸顺利等下的影响及对测定氢气体积的影响;
②硅铝合金中,只有金属铝可以和硫酸反应产生氢气,硅和硫酸之间不反应,根据化学反应中量的关系来计算即可.
解答 解:(1)①装置的组装顺序:合金酸水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
故答案为:E;D;G;
②铝与稀硫酸反应产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,所以稀硫酸不能顺利滴入锥形瓶中,
故答案为:镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;
③实验结束时,该组同学测量实验中生成氢气的体积方法为:待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积,
故答案为:待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积;
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,
故答案为:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,则金属铝的质量是m1-m2,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL,产生气体体积为(V2-V1)ml即产生的气体物质的量是$\frac{({V}_{1}-{V}_{2})×1{0}^{-3}}{{V}_{m}}$,根据化学反应原理:
2Al~3H2↑
2 3
$\frac{{m}_{1}-{m}_{2}}{27}$ $\frac{({V}_{1}-{V}_{2})×1{0}^{-3}}{{V}_{m}}$
解得Vm=$\frac{18({V}_{1}-{V}_{2})}{1000({m}_{1}-{m}_{2})}$L•moL-1,
故答案为:$\frac{18({V}_{1}-{V}_{2})}{1000({m}_{1}-{m}_{2})}$L•moL-1.
点评 本题主要考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,为高考常见题型,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖由碳、氢、氧三种元素组成 | |
| B. | 葡萄糖分子中含有 6 个碳原子和 6 个水分子 | |
| C. | 葡萄糖属于有机化合物 | |
| D. | 葡萄糖的相对分子质量为 180 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键在形成蛋白质结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子光谱可用于测定物质中元素的种类 | |
| C. | a粒子散射实验及布朗运动的发现都对原子模型建立做出了贡献 | |
| D. | X-射线衍射实验可以用来鉴别晶体和非晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )
某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )| A. | a为正极,b为负极;NaClO和NaCl | B. | a为负极,b为正极;NaClO和NaCl | ||
| C. | a为阳极,b为阴极;HClO和NaCl | D. | a为阴极,b为阳极;HClO和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浸取液中加入BaCl2有白色沉淀,不能说明其中含有SO42- | |
| B. | 向浸取液中加入AgNO3溶液有白色沉淀,说明其中含有Cl- | |
| C. | 洁净铂丝蘸取浸取液少许,在酒精灯火焰上灼烧,火焰呈黄色,不能确定是否含K+ | |
| D. | 向浸取液中滴加稀硫酸,产生无色无味的气体,说明其中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-C1 | 330 | H-Se | 314 |
| A. | H2(g)→2H(g)△H=+436kJ/mol | |
| B. | 键长越短,共价键越牢固 | |
| C. | 相同条件下CH3F比CH3C1更易发生水解反应 | |
| D. | 相同压强下,H2S的沸点比H2Se的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
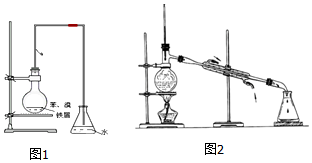 (1)某同学设计如图1装置制取少量溴苯,写出实验室制取溴苯的化学方程式
(1)某同学设计如图1装置制取少量溴苯,写出实验室制取溴苯的化学方程式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com