

分析 (1)等物质的量的SO2与NH3溶于水充分反应生成亚硫酸氢铵,亚硫酸氢根离子电离使溶液显酸性,依据溶液中电荷守恒分析;
(2)①依据电解质溶液中阴阳离子的移动方向判断电极,阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,
②亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子.
解答 解:(1)若将等物质的量的SO2与NH3溶于水充分反应,生成亚硫酸氢铵,亚硫酸氢根离子电离程度大于铵根离子水解程度,使溶液呈酸性,离子浓度由大到小顺序为c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-); c(OH-)<c(H+),电解质溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-)得到:c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),
故答案为:酸; c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-);c(HSO3-)+2c(SO32-)-c(NH4+);
(2)①图中可知,钠离子移向a极,亚硫酸根离子移向b极,所以b极为阳极,应该接电源的正极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,
故答案为:负;硫酸;
②亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,电极反应式为:SO32--2e-+H2O=SO42-+2H+;
故答案为:SO32--2e-+H2O=SO42-+2H+.
点评 本题考查了离子浓度大小比较和电解的原理,明确电解池工作原理是解题关键,注意电解质电极判断的方法和电极反应式书写注意问题为易错点.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和甲醛分别完全燃烧,若消耗的氧气量一样,则它们的质量相等 | |
| B. | 铜丝表面的黑色氧化膜可用酒精除去 | |
| C. | Na2CO3溶液可使苯酚浊液变澄清 | |
| D. | 含0.01mol甲醛的福尔马林溶液与足量的银氨溶液充分反应,生成2.16gAg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸钠具有氧化性,不可能表现出还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2 | |
| D. | 人误食亚硝酸钠中毒时,可服用氢碘酸解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测双氧水的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性KMnO4溶液 | |
| C. | 用托盘天平称取 5.85 g NaCl晶体 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M与Z形成的化合物阳、阴离子个数比均为2:1 | |
| B. | X与Z形成的某种化合物与NZ2反应可生成一种强酸 | |
| C. | Y的含氧酸是强酸 | |
| D. | Z、M、N三种元素组成的某种化合物可与N的最高价氧化物的水化物反应生成N的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室制取氨气 | B. | 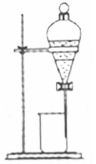 用CCl4萃取碘水中的碘 | ||
| C. | 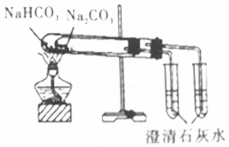 比较Na2CO3与NaHCO3的稳定性 | D. | 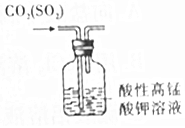 除去CO2中混有的少量SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 1L 0.1mol•L-1 NH4Cl溶液中Cl-的数目为0.1NA | |
| C. | 标准状况下,6.72L NO2与水充分反应转移的电子数为0.2NA | |
| D. | 1mol CH3COOC2H5在足量H2SO4溶液中水解得到的乙醇分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示该反应进行过程中能量的变化.关于该反应的下列说法中,正确的是( )
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示该反应进行过程中能量的变化.关于该反应的下列说法中,正确的是( )| A. | △H>0,△S>0 | B. | △H>0,△S<0 | C. | △H<0,△S<0 | D. | △H<0,△S>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com