
| A. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| C. | 做过银镜反应的试管:加入稀硝酸洗涤 | |
| D. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |
分析 A.乙酸与乙醇的酯化反应为可逆反应;
B.苯酚与NaOH溶液反应后,与苯分层;
C.Ag能与硝酸反应;
D.碘易溶于有机溶剂,不易溶于水.
解答 解:A.乙酸与乙醇的酯化反应为可逆反应,则加入乙醇和浓硫酸,不能使乙酸全部转化为乙酸乙酯,且引入新杂质,应选饱和碳酸钠、分液除杂,故A错误;
B.苯酚与NaOH溶液反应后,与苯分层,静置分层后,分液除去水层,故B正确;
C.Ag能与硝酸反应,则做过银镜反应的试管,可加入稀硝酸洗涤,故C正确;
D.碘易溶于有机溶剂,不易溶于水,则加入CCl4,振荡、静置分层后,取出有机层再蒸馏分离出碘,故D正确;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握有机物的性质、发生的反应及混合物分离原理等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乳酸中不含羟基 | |
| B. | 乳酸不能发生消去反应 | |
| C. | 乳酸与足量钠反应时物质的量之比为1:1 | |
| D. | 乳酸与足量NaOH溶液反应时物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
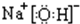
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的无色溶液:Al3+、Cu2+、SO42-、Cl- | |
| B. | 使酚酞试液变红的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 在c(H+)=l×l0-13mol•L-1的溶液中:NH4+、Ba2+、Cl-、NO3- | |
| D. | 含有0.lmol.L-1Fe3+的溶液中:H+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
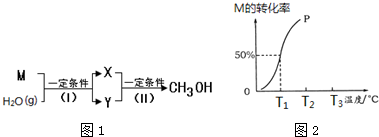
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量守恒、电子守恒、电荷守恒 | B. | 电子守恒、质量守恒、电荷守恒 | ||
| C. | 电子守恒、电荷守恒、质量守恒 | D. | 电荷守恒、质量守恒、电子守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冶炼镁的最后一步反应为电解MgCl2溶液 | |
| B. | 由氯化镁的结晶水合物得到氯化镁属于物理变化 | |
| C. | 利用海水和石灰水作用可以得到氯化镁 | |
| D. | 利用氯化镁冶炼金属镁而不利用氧化镁的原因是氧化镁的熔点太高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com