
| 加入少量盐酸 | 加入少量Na2CO3 | 加入少量NaCl | |
| c(H+) | ① |
减小 | 不变 |
| c(OH-) | ② |
③ |
不变 |
| c(H+)与c(OH-)大小比较 | c(H+)>c(OH-) | c(H+)<c(OH-) | c(H+) ④ |
| 溶液的酸碱性 | 酸性 | ⑤ |
中性 |


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向淀粉溶液中加入稀H2SO4,加热几分钟后,冷却再加入新制Cu(OH)2浊液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| B | 灼烧一小块铝箔 | 熔化的铝并不滴落 | Al2O3的熔点高于Al |
| C | 用洁净的铂丝蘸取化合物X少许,放在酒精灯外焰上灼烧 | 火焰呈黄色, | X一定含钠元素 |
| D | 向Mg(OH)2悬浊液中滴加少量FeCl3溶液 | 出现红褐色沉淀 | Mg(OH)2溶解度大于Fe(OH)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
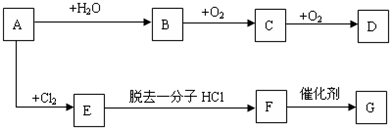
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
ⅠA | 0 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ⑤ | ⑥ | ||||||
| 三 | ② | ③ | ④ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaBr是还原剂 |
| B、Cl2是氧化剂 |
| C、Cl2本身被氧化 |
| D、该反应属于置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com