
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.常温常压下,100 g质量分数为17% 的H2O2溶液中含氧原子数目为NA
C.4.4gCO2与足量Na2O2反应转移电子数为0.1NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
【答案】C
【解析】
A. 5.6 g Fe即物质的量![]() ,足量的盐酸完全反应生成氯化亚铁,因此0.1mol铁失去电子数为0.2 NA,故A错误;
,足量的盐酸完全反应生成氯化亚铁,因此0.1mol铁失去电子数为0.2 NA,故A错误;
B. 常温常压下,100 g质量分数为17% 的H2O2溶液中H2O2的质量为100g×17% = 17g,水的质量为100g – 17g = 83g,H2O2的物质的量![]() ,含有氧原子数目为NA,水中还含有氧原子,因此100g溶液中含有氧原子数目大于NA,故B错误;
,含有氧原子数目为NA,水中还含有氧原子,因此100g溶液中含有氧原子数目大于NA,故B错误;
C. 4.4gCO2的物质的量![]() ,2CO2 + 2Na2O2 = 2Na2CO3 + O2,2mol二氧化碳反应转移2mol电子,因此0.1mol CO2与足量Na2O2反应转移电子数为0.1NA,故C正确;
,2CO2 + 2Na2O2 = 2Na2CO3 + O2,2mol二氧化碳反应转移2mol电子,因此0.1mol CO2与足量Na2O2反应转移电子数为0.1NA,故C正确;
D. 标况下,水的物质的量无法计算,因此无法计算H2O分子的数目,故D错误。
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,被还原的元素是________(填元素符号),过程III的化学方程式为__________。
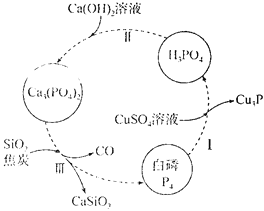
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:
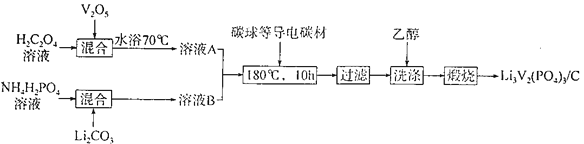
①复合材料中V的化合价为________,C的作用是____________。
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为____________;“洗涤”时用乙醇而不用水的目的是________________。
③锂离子电池是一种二次电池,又称“摇椅”电池。若用和LixC6和Li3V2(PO4)3/C做电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3= Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g铜粉加入100mL0.4mol·L-1的稀HNO3溶液中,加热充分反应后再加入100mL0.2mol·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
A.0.15mol·L-1B.0.2mol·L-1C.0.075mol·L-1D.0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是( )
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为7∶8
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。用化学用语回答下列问题:
(1)F在元素周期表中的位置为__。
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。H的电子式为___,写出在空气中长期放置生成H的化学反应方程式为:__。
(3)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。

则曲线Y表明M中的溶质为___;原NaOH溶液的物质的量浓度为__;由曲线X、Y可知,两次实验通入的CO2的体积比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是( )
A.X可用![]() 饱和溶液
饱和溶液
B.步骤Ⅲ发生的离子反应为![]()
C.工业上每获得1 mol![]() ,至少需要消耗标准状况
,至少需要消耗标准状况![]() 22.4 L
22.4 L
D.步骤Ⅳ涉及的操作有萃取、分液和蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com