
 已知:1molC、1molCO分别按下式反应(燃烧):
已知:1molC、1molCO分别按下式反应(燃烧):分析 (1)煤炭充分产生的热量多和产物无污染;
(2)提高燃料的燃烧效率需要增大燃料与氧气的接触面积,如煤的汽化与液化、将煤粉碎燃烧、液体燃料呈雾状喷出,或通入适量空气使燃烧充分等;
(3)△H=反应物的键能和-生成物的键能和,结合化学方程式计算得到反应焓变,依据热化学方程式书写方法写出对应热化学方程式;
(4)反应③是放热反应,反应物能量高于生成物能量依据能量高低和变化画出能量曲线变化;
(5)依据盖斯定律分析判断,根据1mol碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),利用盖斯定律来分析1mol碳完全燃烧生成CO2(g)所放出的热量.
解答 解:(1)结合数据和反应产物说明,可知煤炭充分燃烧产生的热量多和产物无污染,具有的优点是产生的热量多;产物无污染,故答案为:ab;
(2)A.将煤汽化与液化,得到的产品燃烧热值高,无污染,提高燃料的燃烧效率,故A正确;
B.将液体燃料呈雾状喷出,能增大与空气的接触面积,提高燃料的燃烧效率,故B正确;
C.将煤粉粉碎,能增大与空气的接触面积,提高燃料的燃烧效率,故C正确;
D.将煤压成煤球使用,减小了接触面积,不利于煤的充分燃烧,故D错误.
故选D;
(3)已知CO(s)+$\frac{1}{2}$O2(g)═CO2(g)放热283.0kJ,△H=反应物的键能和-生成物的键能和=x+$\frac{1}{2}$×498KJ/mol-2×803kJ•mol-1=-283.0kJ•mol-1,
解之得:x=+1074kJ,故答案为:1074kJ;
(4)反应③是放热反应,反应物能量高于生成物能量依据能量高低和变化画出能量曲线变化,如图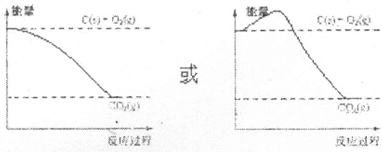 ,故答案为:
,故答案为: ;
;
(5)已知:①C(S)+1/2O2(g)=CO(g)△H=-110.5KJ•mol-1,
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0KJ•mol-1,
利用盖斯定律将①+②可得C(S)+O2(g)=CO2(g)△H=(-110.5kJ•mol-1)+(-283.0kJ•mol-1)=-393.5KJ•mol-1,
即单质碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),所放出的热量之和等于相同质量的碳与氧气完全燃烧生成CO2(g)所放出的热量,
故答案为:相等.
点评 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用和图象变化特征.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 77 | B. | 37 | C. | 191 | D. | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
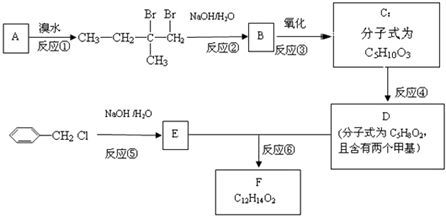
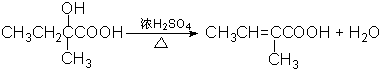 ⑥
⑥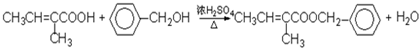
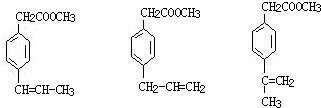 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在卤代烃中,卤素原子与碳原子间形成共价键 | |
| B. | 在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 | |
| C. | 聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 | |
| D. | 卤代烃的沸点比相应烷烃的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K3C60中只有离子键 | B. | K3C60中不含共价键 | ||
| C. | 该晶体在熔融状态下能导电 | D. | C60与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
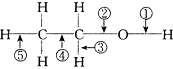
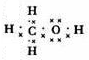 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3(CH2)4CH3 | B. | CH3CH2CHO | C. | CH3CH=CHCH3 | D. | (CH3)3C-C≡C-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com