
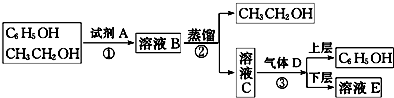
 而不与C2H5OH反应,故可以加入A为NaOH(或KOH等强碱)溶液,B为
而不与C2H5OH反应,故可以加入A为NaOH(或KOH等强碱)溶液,B为 与C2H5OH混合溶液;利用C2H5OH与苯酚钠有较大的沸点差,蒸馏出乙醇,所以C为
与C2H5OH混合溶液;利用C2H5OH与苯酚钠有较大的沸点差,蒸馏出乙醇,所以C为 ;再向所得
;再向所得 的溶液中通入足量的CO2,使苯酚钠转化为苯酚,通过分液操作使之分离,据此分析解答.
的溶液中通入足量的CO2,使苯酚钠转化为苯酚,通过分液操作使之分离,据此分析解答. 而不与C2H5OH反应,故可以加入A为NaOH(或KOH等强碱)溶液,B为
而不与C2H5OH反应,故可以加入A为NaOH(或KOH等强碱)溶液,B为 与C2H5OH混合溶液;利用C2H5OH与苯酚钠有较大的沸点差,蒸馏出乙醇,所以C为
与C2H5OH混合溶液;利用C2H5OH与苯酚钠有较大的沸点差,蒸馏出乙醇,所以C为 ;再向所得
;再向所得 的溶液中通入足量的CO2,使苯酚钠转化为苯酚,通过分液操作使之分离,
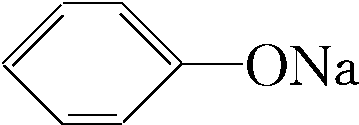
的溶液中通入足量的CO2,使苯酚钠转化为苯酚,通过分液操作使之分离, +CO2+H2O→NaHCO3+
+CO2+H2O→NaHCO3+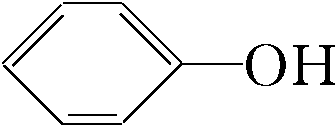 ,
, +CO2+H2O→NaHCO3+
+CO2+H2O→NaHCO3+ .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把镁粉投入氯化铁溶液中,常温下不会有氢气放出 |
| B、工业上通常用煅烧菱镁矿来制取氧化镁 |
| C、镁的主要用途是用于制造合金和照明弹 |
| D、食盐中如含氯化镁就易潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Na | Cu | Al | Fe | |
| 熔点/℃ | 97.8 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2567 | 2467 | 2750 |
| A、Cu和Al |
| B、Fe和Cu |
| C、Cu和Na |
| D、Al和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水电离出来的c(H+)=1×10-13mol/L的溶液中Fe3+、NH4+、NO3-一定不能大量共存 |
| B、AlCl3溶液蒸干后得到的固体是AlCl3 |
| C、在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时电池内部Li+向负极移动 |
| B、电池的负材料为Li |
| C、放电过程中,电池正极材料发生氧化反应 |
| D、充电时阴极反应为:FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
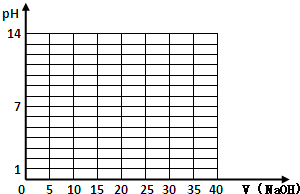
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com