

 ;
; ;
;| 1 |
| 4 |
| 1 |
| 8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、干电池放电之后还能再充电 |
| B、充电电池在放电和充电时都是将化学能转化为电能 |
| C、充电电池可以无限制地反复放电、充电 |
| D、氢氧燃料电池是一种环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、可用新制的氢氧化铜悬浊液检验淀粉是否水解完全 |
| D、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升髙温度,v正变大,v逆变小 |
| B、恒温恒容,充入O2,02的转化率升高 |
| C、恒温恒压,充人N2,平衡不移动 |
| D、恒温恒容,平衡前后混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的非金属性越强,单质的活泼性一定越强 |
| B、分子晶体中分子间的作用力越大,分子越稳定 |
| C、离子晶体发生状态变化时,一定会破坏离子键 |
| D、分子中含有两个氢原子的酸,一定就是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1=c2 |
| B、c1>c2 |
| C、c1≥c2 |
| D、c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微热 |
A、 |
B、 |
C、 |
D、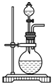 |
查看答案和解析>>
科目:高中化学 来源: 题型:
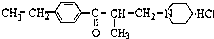 盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构筒式如图:关于盐酸乙哌立松片有下列说法其中正确的是( )
盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构筒式如图:关于盐酸乙哌立松片有下列说法其中正确的是( )| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com