
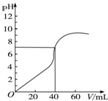
 25℃时,用1.0mol•L-1 NaOH溶液中和某浓度H2SO4溶液40mL,其pH和所加NaOH溶液的体积关系如图所示.求:(写出必要的解题过程)
25℃时,用1.0mol•L-1 NaOH溶液中和某浓度H2SO4溶液40mL,其pH和所加NaOH溶液的体积关系如图所示.求:(写出必要的解题过程)分析 加入氢氧化钠之前,硫酸的pH=0,可计算硫酸的浓度,根据加入氢氧化钠40mL时,溶液的pH=7,可以计算氢氧化钠的浓度,根据Kw=c(H+)•c(OH-)可以算NaOH溶液中由水电离出的c(OH-).
解答 解:加入氢氧化钠之前,硫酸的pH=0,可得到c(H+)=1.0mol/L,所以硫酸的浓度是0.05mol/L,加入氢氧化钠40mL时,溶液的pH=7,此时恰好完全中和,则1.0mol/L×0.04L=c(NaOH)•0.04L,解得c(NaOH)=1.0mol/L;
(1)1.0mol•L-1 NaOH溶液中由水电离出的c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1×1{0}^{-14}}{1.0}$mol/L=1.0×10-14 mol/L,答:1.0mol•L-1 NaOH溶液中由水电离出的c(OH-)是1.0×10-14mol/L;
(2)加入氢氧化钠之前,硫酸的pH=0,可得到c(H+)=1.0mol/L,所以硫酸的浓度是0.05mol/L,答:原H2SO4溶液的物质的量浓度0.50 mol/L.
点评 本题考查学生pH的计算以及水的离子积常数的计算,注意图中信息的应用是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C4H6、C3H8 | B. | C2H2、C6H6 | C. | C2H6O、C2H4 | D. | C3H6、C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
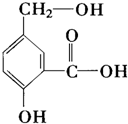
| A. | 该有机物难溶于水 | |
| B. | 该物质能与溴水反应,生成难溶于水的沉淀 | |
| C. | 该分子中至少有12个原子共平面 | |
| D. | 1 mol该物质与足量的金属钠反应,放出3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中可能有SO42- | |
| B. | 某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中可能有Cl- | |
| C. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中可能有CO32- | |
| D. | 某溶液中滴入氢氧化钠溶液,生成白色沉淀,说明原溶液中可能有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 4.9mol/L | B. | 9.8mol/L | C. | 18.4mol/L | D. | 36.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气的平均相对分子质量不再改变 | |
| B. | 反应器内A、B、C、D物质的量比为1:3:3:2 | |
| C. | 容器内密度不随时间变化而变化 | |
| D. | 生成 1mol A同时有3 mol C被消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氯化钠(NaCl) | ≥98.0%(以NaCl计) |
| 碘酸钾(KIO3) | (35±15)mg/Kg(以I计) |
| A. | 此食盐是纯净物 | |
| B. | “加碘食盐”中的“碘”是指碘单质 | |
| C. | 1Kg此食盐中含碘酸钾(35±15)mg | |
| D. | “菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com