
| X | |||
| Z | Y | W |
| A. | X、Y、W的氧化物都属于酸性氧化物 | |
| B. | 工业上采用电解Z的氯化物制备Z单质 | |
| C. | W的单质易溶于XW2 | |
| D. | 1molX或Y的最高价氧化物分子中都含有2mol双键 |
分析 为元素周期表短周期的一部分,由元素在周期表中位置,可知X处于第二周期,Z、Y、W处于第三周期,其中W元素的最高正价与最低负价的代数和为4,处于ⅥA族,故W为S元素,可推知X为C、Y为Si、Z为Al,据此解答.
解答 解:为元素周期表短周期的一部分,由元素在周期表中位置,可知X处于第二周期,Z、Y、W处于第三周期,其中W元素的最高正价与最低负价的代数和为4,处于ⅥA族,故W为S元素,可推知X为C、Y为Si、Z为Al.
A.CO不属于酸性氧化物,故A错误;
B.工业电解熔融氧化铝制备金属铝,故B错误;
C.硫单质易溶于CS2中,故C正确;
D.二氧化硅固体中不存在分子,且不含有双键,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素化合物知识理解掌握.


科目:高中化学 来源: 题型:选择题
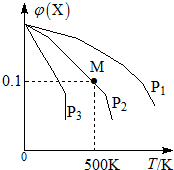 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | B. | 压强大小有P3>P2>P1 | ||
| C. | 平衡后加入高效催化剂使Mr增大 | D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验. 序号 | 碳酸钙 | C(HCl)/ mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含HS-溶液中:K+、Cu2+ NO3-、SO42- | |
| B. | 某无色透明的溶液:Mg2+、ClO-、SiO32- Na+ | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+ K+、NO3- HCO3- | |
| D. | pH=0:Na+ Ca2+ Fe3+ NO3- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
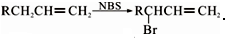 .醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
.醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路: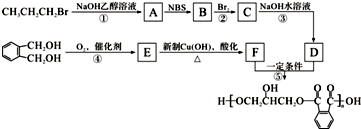
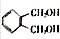
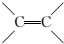 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.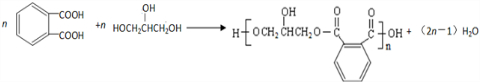 .
. 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.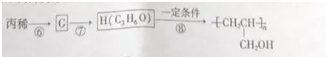
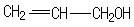 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
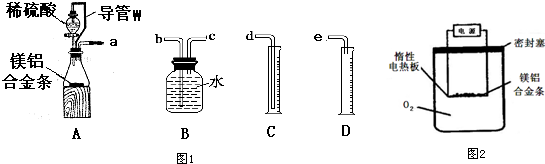
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
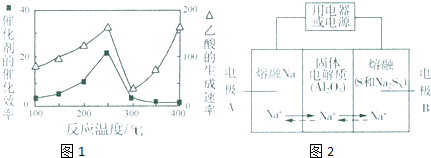
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
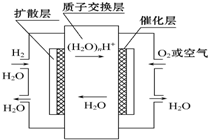
| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com