
【题目】一种回收并利用含碘(I-)废液(废液中杂质沉淀后进入滤液中)的工艺流程如下:
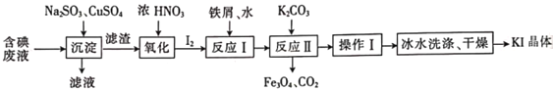
(1)“沉淀”后滤渣为______________________(填化学式,其中滤渣中Cu元素为+1价)
(2)“氧化”反应的离子方程式为______________________。
(3)反应I中只生成化合物FexIy(其中I与Fe的质量比为127︰21),反应中铁屑是___________(填“氧化剂”“还原剂”或“催化剂”,下同),水是___________。反应消耗的铁与转移电子的物质的量之比为___________。
(4)反应Ⅱ的化学方程式为_________________________________。
(5)操作I除蒸发皿、酒精灯外还需用到的玻璃仪器有______________________。冰水洗涤的目的是_________________________________。
【答案】CuI 2CuI+4NO3-+8H+=2Cu2++I2+4NO2↑+4H2O 还原剂 催化剂 3:8 Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑ 玻璃棒、漏斗、烧杯 除去KI表面的可溶性杂质,同时减少其溶解损失
【解析】
结合流程可以知道回收废液中碘离子的步骤为:先向废液中加入亚硫酸钠、硫酸铜溶液生成CuI沉淀,过滤得到滤渣CuI,然后加入浓硝酸氧化CuI,向氧化产物碘单质中加入铁屑和水后得到FexIy,FexIy与碳酸钾溶液反应生成Fe3O4、KI和CO2;过滤后将反应Ⅱ的滤液经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;因为碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,同时为了减少KI的溶解损失,需要用冰水洗涤,最后得到纯净的碘化钾,据此分析。
结合流程可以知道回收废液中碘离子的步骤为:先向废液中加入亚硫酸钠、硫酸铜溶液生成CuI沉淀,过滤得到滤渣CuI,然后加入浓硝酸氧化CuI,向氧化产物碘单质中加入铁屑和水后得到FexIy,FexIy与碳酸钾溶液反应生成Fe3O4、KI和CO2;过滤后将反应Ⅱ的滤液经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;因为碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,同时为了减少KI的溶解损失,需要用冰水洗涤,最后得到纯净的碘化钾。
(1)由于滤渣中Cu为+1价,“沉淀”后滤渣为CuI;
(2)“氧化”时是滤渣与浓硝酸反应生成硝酸铜、碘、二氧化氮和水,反应的离子方程式为2CuI+4NO3-+8H+=2Cu2++I2+4NO2↑+4H2O;
(3)反应I中铁由单质变为铁的化合物,化合价升高,作为还原剂;加入水可以加快反应速率,水起到了催化剂的作用,水是催化剂;在反应中生成铁与碘的化合物,其中铁元素与碘元素的质量比为21:127,即Fe与I物质的量之比为:![]() :
:![]() =3:8,反应Ⅰ生成物化学式是 Fe3I8,根据碘的化合价,碘的化合价由0价变为-1价,则反应消耗的铁与转移电子的物质的量之比为3:8;
=3:8,反应Ⅰ生成物化学式是 Fe3I8,根据碘的化合价,碘的化合价由0价变为-1价,则反应消耗的铁与转移电子的物质的量之比为3:8;
(4)根据流程Fe3I8与碳酸钾溶液反应生成Fe3O4、KI和CO2,反应Ⅱ的化学方程式为Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
(5)操作I包括蒸发浓缩、冷却结晶、过滤,除蒸发皿、酒精灯外,还需用到的玻璃仪器有玻璃棒、漏斗、烧杯;冰水洗涤的目的是除去KI表面的可溶性杂质,同时减少其溶解损失。


科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3 kJ·mol-1
H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为142.9 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) ===2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) ===2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2 O(1)=2HCl(aq)+H2SO4 (aq) △H4=____________________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
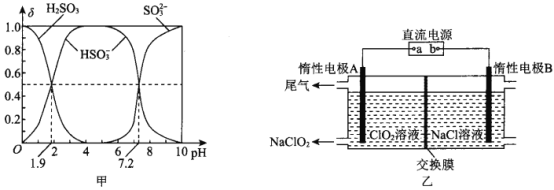
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备 NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)
②阳极的电极反应式为________________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)

(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图(I)所示:
①图(I)中三组实验从反应开始至达到平衡时,v(CO)最大的为___________(填序号)
②与实验a相比,c组改变的实验条件可能是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)Zn﹣MnO2干电池应用广泛,其电解质溶液是ZnCl2﹣NH4Cl混合溶液。该电池的负极材料是______.电池工作时,电子流向______(填“正极”或“负极”)。
若ZnCl2﹣NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的反应.其主要原因是_________________。
(2)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为:
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
该蓄电池放电时,电解质溶液中阴离子移向_____________(填“正极”或“负极”);正极附近溶液的酸性_______(填“增强”、“减弱”或“不变”)放电时,负极的电极反应式为:________________。
(3)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为_________________________________。该电池工作时,外电路每流过2 mole-,消耗标况下氧气____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | ①_____ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | ②_____ |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____(填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | 15.90 |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以香兰醛(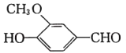 )为主要原料合成药物利喘贝(V)的流程如下:
)为主要原料合成药物利喘贝(V)的流程如下:
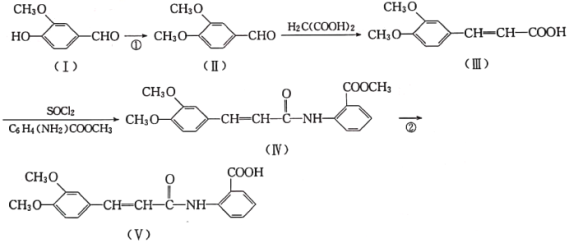
已知:![]() (酰胺键)在无肽键酶作用下的水解可忽略。
(酰胺键)在无肽键酶作用下的水解可忽略。
(1)H2C(COOH)2的化学名称为___________。
(2)①的反应类型是___________。
(3)反应②所需试剂条件分别为___________、___________。
(4)利喘贝(V)的分子式为___________。
(5)Ⅲ中官能团的名称是______________________。
(6)写出与香兰醛互为同分异构体的酯类化合物的结构简式(且核磁共振氢谱为四组峰,峰面积之比为1:2:2:3):____________________________________________(写出3种)。
(7)已知:![]() ,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(
,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(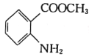 )的合成路线(其他无机试剂任选):__________________________________________________________________。
)的合成路线(其他无机试剂任选):__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
(2)写出下列反应的离子方程式:
①金属A和水__________________________________________。
②物质B和气体乙_______________________________________。
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因_______________________。
(4)用化学方程式解释F长期放置在空气中失效的原因___________________________。
(5)红热细铁丝能在气体乙剧烈燃烧,现象是____________________,将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在_________之间。向氢氧化铁胶体中滴入过量稀硫酸,现象是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将 2 mol 气体A 与 1 mol 气体B 充入一个体积不变的容器内,发生反应:2A+B C+3D+4E,达到平衡后气体A 的浓度减少一半,发现有液体生成,在相同的温度下测得反应 前后压强分别为 6.06×106 Pa 和 8.08×106 Pa,又测得反应共放出热量 Q kJ,下列说法正确的是( )
A. 该反应在任何温度下都可自发进行
B. 在上述平衡体系中再加入 1 mol A 和 0.5 mol B,平衡正向移动,A 的转化率增大
C. 该反应的热化学方程式为 2A(g)+B(g) C(g)+3D(l)+4E(g) ΔH= -Q kJ/mol
D. 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的己烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 1mol羟基所含电子数为7 NA
D. 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com