
分析 二氧化氮和氧气,将其倒立于盛有水的水槽中,发生反应4NO2+O2+2H2O=4HNO3,当两者恰好完全反应,二氧化氮与氧气的物质的量之比为4:1,即二氧化氮的体积为8ml,如果氧气过量,则0<x≤8时,则:y=(10-x)-$\frac{x}{4}$=10-$\frac{5x}{4}$;如果二氧化氮过量
4NO2+O2+2H2O=4HNO3
4 1
x 10-x
若NO2过量,则剩余的NO2为:x-4(10-x)=5x-40
NO2继续与水反应:3NO2+H2O=2HNO3+NO,由此分析解答.
解答 解:二氧化氮和氧气,将其倒立于盛有水的水槽中,发生反应4NO2+O2+2H2O=4HNO3,当两者恰好完全反应,二氧化氮与氧气的物质的量之比为4:1,即二氧化氮的体积为8ml,(1)如果氧气过量,则0<x≤8时,则:y=(10-x)-$\frac{x}{4}$=10-$\frac{5x}{4}$;
(2)如果二氧化氮过量,8<x<10时,
4NO2+O2+2H2O=4HNO3
4 1
x 10-x
若NO2过量,则剩余的NO2为:x-4(10-x)=5x-40
NO2继续与水反应:
3NO2+H2O=2HNO3+NO
3 1
5x-40 y
y=$\frac{5x-40}{3}$;
故答案为:当0<x≤8时,则:y=(10-x)-$\frac{x}{4}$=10-$\frac{5x}{4}$;8<x<10时,y=$\frac{5x-40}{3}$.
点评 本题考查了有关混合物反应的化学计算,题目难度中等,明确反应后剩余气体组成为解答关键,注意掌握二氧化氮与氧气、水转化成硝酸的反应原理,要求学生掌握讨论法在化学计算中的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
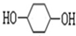 的路线如下所示,请按要求作答:
的路线如下所示,请按要求作答:
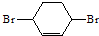 )
)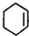 ,F
,F .
.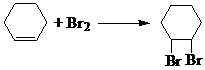 ;④
;④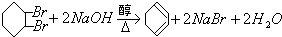 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
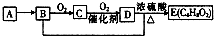 已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )
已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 图表涉及的反应类型有加成、取代、氧化 | |
| D. | B+D→E的化学方程式:C2H5OH+CH3COOH→CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: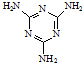 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向AgNO3和CuCl2的混合溶液中缓慢通入氨水溶液 | |
| B. |  向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| C. | 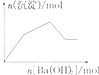 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 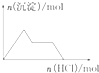 NaAlO2溶液中逐滴加入盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:
氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构片段为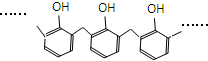 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 | |
| B. | 按系统命名法,化合物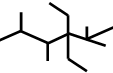 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| C. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 | |
| D. | 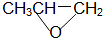 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物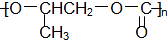 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com