

| A.用此法提取镁的优点之一是原料来源丰富 |
| B.步骤⑦电解MgCl2时阴极产生氯气 |
| C.步骤⑥可将晶体置于HCl气氛中脱水 |
| D.上述工艺流程中涉及化合、分解和复分解反应 |
科目:高中化学 来源:不详 题型:单选题
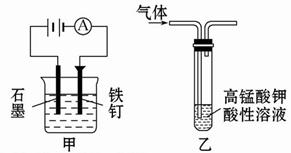
| A.装置甲:防止铁钉生锈 |
| B.测定同温同浓度的NaCl和NaF溶液的pH,确定F、Cl两元素的非金属性的强弱 |
| C.装置乙:除去乙烷中混有的乙烯 |
| D.用Ca(OH)2溶液来鉴别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
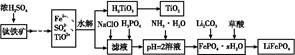
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4·5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 温度物理溶解度 | 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | 60 ℃ |
| FeSO4·7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4·FeSO4·6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 仪器符号 | 仪器中所加物质 | 装置作用 |
| B | | |
| C | | |
| C | 氢氧化钠浓溶液 | |
| C | | |
| D | | |
| E | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
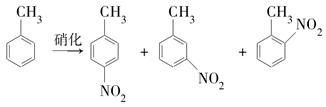
| 催化剂 |  | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2 | B.HCl | C.NaOH | D.Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com