
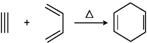
 .若要合成
.若要合成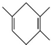 ,则所用的反应物可以是
,则所用的反应物可以是| A. | ①④ | B. | ①② | C. | ②④ | D. | ②③ |
分析 据1,3-丁二烯与乙炔反应 知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成
知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成 ,逆向推断
,逆向推断 或者是
或者是 ,以此解答该题.
,以此解答该题.
解答 解:根据1,3-丁二烯与乙炔反应 知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成
知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成 ,逆向推断
,逆向推断 或者是
或者是 ,若为
,若为 ,则有机物的命名原则两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔;
,则有机物的命名原则两种原料分别是2,3-二甲基-l,3-丁二烯和丙炔;
若为 ,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔;
,则两种原料分别为2-甲基-l,3-丁二烯和2-丁炔;
故选:A.
点评 本题考查有机物合成及结构与性质,为高频考点,把握常见有机物官能团与性质、反应类型为解答的关键,注重知识迁移应用的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若保持温度,保持容器容积固定不变,向容器内补充B气体,则有a<b | |
| B. | 若保持温度、压强不变,充入惰性气体,则有a>b | |
| C. | 若其他条件不变,升高温度,则有a<b | |
| D. | 若a=b,则可能是在该温度下,保持容器容积固定不变情况下充入了惰性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
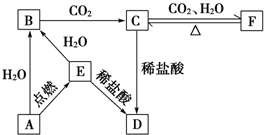
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液A和B均可以是稀硫酸或NaOH溶液 | |
| B. | 若溶液B选用浓硝酸,则测得铜的质量分数偏大 | |
| C. | 溶液A和B均不可选用浓硝酸 | |
| D. | 实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加入BaCl2,产生白色浑浊说明该溶液中一定有SO42- | |
| B. | 向淀粉碘化钾溶液中加氯水,溶液变为蓝色说明氯气的氧化性强于碘单质 | |
| C. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定有CO32- | |
| D. | 某溶液滴加稀盐酸无明显现象,再加硝酸银产生白色沉淀,说明溶液中含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和体积相同的CO和NO | B. | 同温同压下的CO和NO | ||
| C. | 质量相同,密度不同的 CO 与N2 | D. | 体积和压强都相同的CO和NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁易被腐蚀,纯铁不易被腐蚀 | |
| B. | 常温下可用铁制容器来运输浓硫酸 | |
| C. | Fe2+的检验:取少量样品溶液,加入适量氯水,再滴2滴KSCN溶液,振荡观察 | |
| D. | 工业上常用稀盐酸或稀硫酸除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
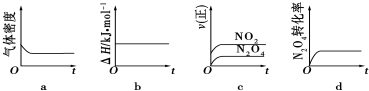
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验中温度计的水银球应插入溶液中 | |
| B. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 | |
| C. | 分液时,先打开玻璃塞,再打开旋塞,使下层液体从下口流出,上层液体从上口倒出 | |
| D. | 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com