

| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6KJ•mol-1 | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
分析 A.表示燃烧热时应生成液态水.
B.可逆反应2NO2?N204(g)中,分析判断 二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1,说明反应达到平衡状态;
C.A、B两物质的溶解度均随温度升高而增大,由t1℃升温至t2℃时,A、B溶液浓度不变;
D.酸性越弱对应盐的水解显碱性,水解程度越大,溶液pH越大.
解答 解:A.表示燃烧热时应生成液态水,而图中为气态水,不是最稳定的物质,则不能表示为燃烧热,故A错误.
B.可逆反应2NO2?N204(g)中,分析判断,二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1时才能说明反应达到平衡状态,交点只是浓度相同不能证明达到终点,故B错误;
C.A、B两物质的溶解度均随温度升高而增大,由t1℃升温至t2℃时,A、B溶液浓度均不变,都没有达到饱和溶液,故C错误;
D.依据图象乙,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化HA溶液PH变化大,酸性HA>HB,同浓度的NaA溶液的pH小于NaB溶液,故D正确.
故选D.
点评 本题考查较为综合,以图象为载体考查学生的分析能力,为高考常见题型和高频考点,题目测总考查化学反应能量守恒判断,弱电解质溶液稀释后溶液酸性强弱比较,注意把握图象曲线变化的意义,把握相关基本反应原理的理解,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在20~25min之间,pH=10时R的平均降解速率为0.04 mol•L-1•min-1 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气取代 | B. | 乙烯与氢气加成,再用氯气取代 | ||
| C. | 乙烯与氯化氢加成 | D. | 乙烯与氯气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 0.1 mol/LFeCl3溶液中大量存在:Fe2+、NH4+、SCN-、SO42- | |
| C. | 加入Al粉产生H2的溶液中可能大量存在:K+、Na+、NO3-、Cl- | |
| D. | 中性溶液中可能大量存在:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )
X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )| A. | 原子半径:X>Y>Z>W | |
| B. | 简单气态氮化物的热稳定性:W>X | |
| C. | 最高价氧化物对应的水化物的碱性:Z>Y | |
| D. | X和W组成的化合物常作砂纸、砂轮的磨料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
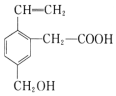
| A. | 有机物的分子式为C11H14O3 | |
| B. | 有机物中含有4种不同的官能团 | |
| C. | 0.5 mol 该有机物与足量NaOH溶液反应,消耗NaOH 1mol | |
| D. | 0.5 mol 该有机物与足量金属钠反应,能生成标准状况下的氢气11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键 | |
| B. | 乳酸有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释 | |
| D. | 酸性:HClO4>HClO,因为HClO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com