
【题目】下列实验现象预测正确的是

A. 实验I:振荡后静置,上层溶液颜色保持不变
B. 实验II:酸性KMnO4溶液中无明显现象
C. 实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.NO2、Cl2O7都是酸性氧化物
B.水银、水玻璃都是混合物
C.HD、HCHO都是化合物
D.干冰、可燃冰都是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常常会大量的废料,如果不加以回收利用甚至会造成环境污染,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。

请回答:
(1)写出步骤Ⅰ反应的离子方程式:_________________________。
(2)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是____________。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是____________________。

(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径②中反应的离子方程式:__________________________,
请选出你认为的最佳途径并说明选择的理由:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(g)N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是
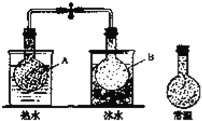
A. 上述过程中,A烧瓶内正、逆反应速率均加快
B. 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C. 上述过程中,A、B烧瓶内气体密度均保持不变
D. 反应2NO2(g)N2O4(g)的逆反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但必不可少的化学元素有( )
A. Fe Mn Zn Mg
B. Zn Cu Mn Ca
C. H 0 Na Mg
D. Zn Cu B Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用纯净的KCl固体,但目前只有含K2SO4、(NH4)2CO3杂质的KCl。某学生设计了如图所示方案进行提纯。
已知:1.(NH4)2CO3![]() 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
2.K2SO4、KCl热稳定性好,KCl溶解度随温度变化不大;
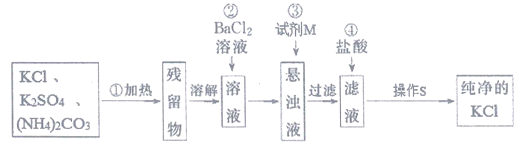
根据以上信息,回答下列问题:
(1)步骤①加热的目的是:______________;此操作可选择在______________(填仪器名称)中进行;
(2)步骤②不用硝酸钡溶液,其理由是_________________;
(3)进行步骤②时,简述判断SO42-是否除尽的实验操作、现象和结论:____________;
(4)步骤③所加试剂M为:_______________,其目的是_________________;
(5)操作S的名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液滴入酚酞变红
B. 铁在潮湿的环境下生锈
C. 加热氯化铁溶液颜色变深
D. 用氯化铵溶液除去铁锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2 == P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解。
(1)已知:
化学键 | 断开1mol化学键所需的能量(kJ) |
H-H | 436 |
O-H | 463 |
O=O | 498 |
①H2O的电子式是________________。
②H2O(g)分解的热化学方程式是________________________。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出__________kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 | |
a | 50 mL5%H2O2溶液 | 1 mL0.1 mol·L-1FeCl3溶液 | |
b | 50 mL5%H2O2溶液 | 少量浓盐酸 | 1 mL0.1 mol·L-1FeCl3溶液 |
c | 50 mL5%H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
d | 50 mL5%H2O2溶液 | MnO2 | |
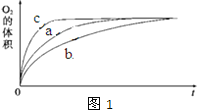
① 测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。由该图能够得出的实验结论是______________________。
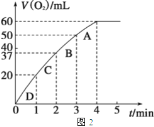
② 测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因________________;计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com