
|
一定量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓慢经过无水氯化钙(足量)时,氯化钙增重25.2 g,则原混合气体中CO2的质量为 | |
| [ ] | |
A. |
24.4 g |
B. |
19.7 g |
C. |
13.2 g |
D. |
12.5 g |
科目:高中化学 来源: 题型:阅读理解
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
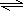 CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0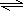 NH3?H2O+H+
NH3?H2O+H+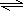 NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 _______ 。
(2)某种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
已知该电池负极的电极反应为:C4H10+2O2--4e-=CO2+H2O,则该电池正极的电极反应式为 _______ ,电池工作时,固体电解质里的O2-向 _______ 极移动。
![]() (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表: T℃时物质的浓度(mol/L)变化
| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 _______ ,第5~6min之间,改变的条件是 _______ 。T℃时该化 学反应的平衡常数是 _______ 。
②已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 _______ 。
③397℃时该反应的平衡常数为12,请判断该反应的△H _______ 0(填“>”、“=”、“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(17分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式为:
CH4(g)+2O?2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(l)=H2O(g) △H=+44kJ?mol-1
则356g“可燃冰”(分子式为CH4?9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为 。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:正极反应式:
O2+2CO2+4e-=2CO2-3,负极反应式 。
(3)已知一氧化碳与水蒸气的反应为:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol/L)变化
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | c1 |
6 | 0.096 | 0.266 | 0.104 | c2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
②已知420℃时,该化学反应的平衡常数为9,如果反应开始时,CO(g)和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为 。
③397℃时,该反应的化学平衡常数为12,请判断该反应的△H 0(填“>、=、<”)。
(4)燃料电池中产生的CO2气体可以用碱液吸水得到Na2CO3和NaHCO3。常温下向20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。根据图象回答下列问题:

①在同一溶液中,H2CO3、HCO-3、CO2-3(填:“能”或“不能”) 大量共存。②当pH=7时溶液中含碳元素的主要微粒为 ,此时溶液中c(HCO-3) c(Na+)(填“>、=、<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的甲烷燃烧后得到CO、CO2和水蒸气三种产物,此混合气体的质量为49.6 g,当其缓慢通过无水CaCl2时,CaCl2增重25.2 g,则:
(1)三种产物混合气体中的CO物质的量为 mol;
(2)将产物混合气体中的CO2通入足量澄清石灰水中得沉淀 g;
(3)要使此甲烷完全燃烧还需O2的物质的量为 mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com