
1.下列说法中正确的是( )
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③活化分子比普通分子具有较高的能量 ④化学反应的实质是原子的重新组合 ⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程 ⑥化学反应的实质是活化分子有合适取向的有效碰撞
A.①③④⑤ B.②③⑥ C.④⑤⑥ D.②④⑤
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
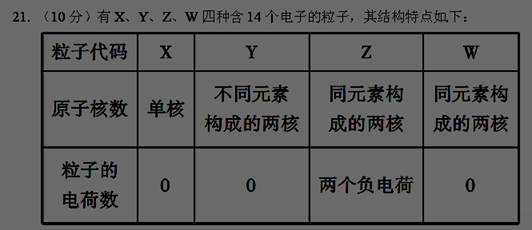
(1) A原子核外比X原子多3个电子,A的原子结构示意图是________;含1 mol X的氧化物晶体中含有共价键数目为________。
(2) Z与钙离子组成的化合物的电子式为________________。
(3) 14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式:______________________________。
(4) 组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略):

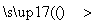

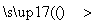

① 写出丁在高温下与水反应的化学方程式:__________________;
② 组成W的元素的简单氢化物极易溶于水的主要原因是__________________________,
该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列常见实验的现象或表述正确的是( )。
A.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
B.为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁
C.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D.将(NH4)2Fe(SO4)2·6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质
查看答案和解析>>
科目:高中化学 来源: 题型:
设C+CO2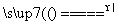 2CO,正反应是吸热反应,反应速率为v1。N2+3H2
2CO,正反应是吸热反应,反应速率为v1。N2+3H2
 2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
2NH3,正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2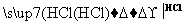 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 | 初始浓度c/mol·L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.001 0 | 290 |
| ② | 1.60 | 0.20 | 0.001 0 | 145 |
| ③ | 0.80 | 0.40 | 0.001 0 | 145 |
| ④ | 0.80 | 0.20 | 0.002 0 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大[CH3COCH3],v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大[HCl],v(Br2)增大
D.增大[Br2],v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2
⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极。
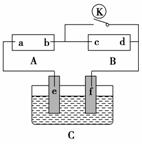
(2)滤纸B上发生的总化学反应方程式为__________________________________________________________
__________________________________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为__________________________,电极f上发生的反应为________________________,槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,0.1 mol·L-1的硫化钠溶液和0.1 mol·L-1的碳酸钠溶液,碱性更强的是__________,其原因是___________________________________________________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com