
| A. | 若原子半径X>Y,则气态氢化物稳定性:HmX<HnY | |
| B. | X、Y一定不是同周期元素 | |
| C. | 由mXa-与nYb-得m+a=n-b | |
| D. | Xa-的还原性一定强于Yb- |
分析 A.若为非金属元素,则X、Y位于同周期,原子序数越大,原子半径越小,其非金属性强,其氢化物越稳定;
B.X、Y均为阴离子、或均为阳离子在同一周期,否则不在同一周期;
C.简单离子的电子层结构相同,则核外电子数相同;
D.同周期非金属元素,原子序数越大的非金属性强,对应离子的还原性弱.
解答 解:A.若为非金属元素,则X、Y位于同周期,原子序数越大,原子半径越小,其非金属性强,其氢化物越稳定,则若原子半径X>Y,则气态氢化物稳定性:HmX<HnY,故A正确;
B.X、Y均为阴离子、或均为阳离子在同一周期,否则不在同一周期,所以X、Y可能是同周期元素,故B错误;
C.简单离子的电子层结构相同,则核外电子数相同,由mXa-与nYb-得m+a=n+b,故C错误;
D.同周期非金属元素,原子序数越大的非金属性强,对应离子的还原性弱,由于不知道二者原子序数大小关系,所以无法判断阴离子的还原性强弱,故D错误.
故选A.
点评 本题考查原子结构和元素周期律,明确电子层结构相同的离子在周期表中的位置是解本题关键,注意X、Y是阳离子还是阴离子,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子化合物中一定存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 王水能溶解黄金,但不能溶解白金 | |
| B. | HAuCl4具有很强的氧化性 | |
| C. | 盐酸有很强的还原性 | |
| D. | 浓盐酸和浓硝酸按照体积比1:3能配成王水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
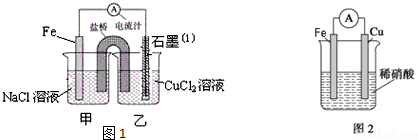
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:
某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯锌与稀硫酸反应 | B. | 纯锌和浓硫酸反应 | ||
| C. | 纯锌与稀盐酸反应 | D. | 粗锌(含铅、铜杂质)与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X和Y可能是KOH和CH3COOH | |
| B. | X和Y可能是NH3•H2O和HCl | |
| C. | X和Y恰好中和时,溶液呈中性 | |
| D. | X和Y恰好完全反应时的溶液中由水电离出的c(H+)=1×10-8mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com