
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 半径(pm) | 30 | 64 | 66 | 91 | 70 | 106 | 110 | 186 | 125 | 232 |
| 主要化合价 | -1,+1 | -1 | -2 | -4,+4 | -3,+5 | -2,+4,+6 | -4,+4 | +1 | +3 | +1 |

 ,故答案为:第二周期第ⅤⅡA族;
,故答案为:第二周期第ⅤⅡA族; ;
; ,
, ;SiH4;H2SiO3;Na+[:H]-;
;SiH4;H2SiO3;Na+[:H]-; ;
;
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:
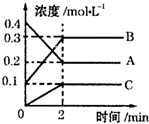 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.| 实 例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | |
| ②实验室将块状药品研细,再进行反应 | |
| ③用H2O2分解制O2时,加入MnO2 | |
| ④实验室制备H2时,用较浓的硫酸与Zn粒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| m |
| n |
| m |
| n |
查看答案和解析>>
科目:高中化学 来源: 题型:
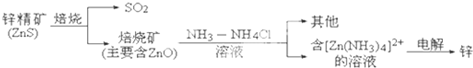
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加C的质量 |
| B、保持体积不变,充入氦气使体系压强增大 |
| C、加入催化剂 |
| D、保持压强不变,充入氦气使容器体积增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com