
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
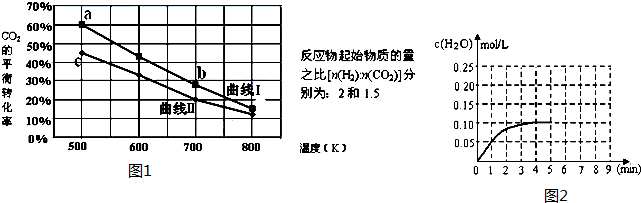
分析 (Ⅰ)(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)反应自发进行的判断依据是△H-T△S<0;
(3)平衡常数随温度变化,某温度下,(1)中反应的平衡常数K=0.25,改变下述条件可使K=2.04,说明改变温度平衡正向进行;
(4)从化学平衡的定义来看,判断一个可逆反应是否达到平衡有两个标志:一是正逆反应速率相等,二是各组分的浓度不再变化;平衡常数随温度变化,依据平衡常数概念结合平衡常数变化和平衡移动原理分析平衡发生移动的方向;根据外界条件对反应速率的影响分析判断速率变化,提高物质转化率的方法是增加另一种物质,分离出生成物,改变温度、压强平衡正向进行;
(Ⅱ)(1)考查平衡常数的应用,比较Qc与K的关系,要使反应向 正方向进行应满足Qc小于K;
(2)反应物有两种或两种以上,增大一种反应物的量可以提高另一种反应物的转化率;
(3)根据外界条件对反应速率的影响分析判断,降低温度、减小浓度、减小压强等都减小反应速率;
(Ⅲ)(1)A、根据转化率无法判断起始量;
B、根据速率之比等于计量数之比可知,达平衡时,v(H2)正=3v(CO2)逆;
C、利用三段式计算,设起始H2为2mol,则CO2为1mol,
6H2 +2CO2?C2H5OH+3H2O
起始(mol) 2 1 0 0
转化(mol)1.8 0.6
平衡(mol)0.2 0.4
H2的平衡转化率为$\frac{1.8}{2}$×100%=90%;
D、b点温度高于c点,根据温度对平衡常数的影响作判断;
(2)在体积为2L的密闭容积中加入0.4molCO2和0.4molH2,第4分钟达到平衡,水的浓度为0.1mol/L,在第5分钟时,向体系中再充入0.2molCO2和0.2mol H2(其他条件不变),平衡逆向移动,水的浓度增大,曲线起始时水的浓度为0.1mol/L,随反应进行第8分钟达到平衡,此时水的浓度结合化学平衡常数计算得到,据此画出曲线的变化.
解答 解:(Ⅰ)(1)①CO2(g)+3H2(g)?CH2OH(g)+H2O(g)△H=-49.5kJ•mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1
盖斯定律计算①-②得到由CO和H2制取甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol;
(2)CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol,反应的焓变△H<0,△S<0,满足△H-T△S<0的自发进行的反应条件为低温;
故答案为:低温;
(3)平衡常数随温度变化,某温度下,(1)中反应的平衡常数K=0.25,改变下述条件可使K=2.04,说明改变温度平衡正向进行,钙反应是放热反应,实验降低温度平衡正向进行,故选D;
故答案为:D;
(4)反应Ⅰ,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应是气体体积减小的放热反应,在一定温度下反应达到平衡的标志是正逆反应速率相同;在一定温度下反应达到平衡的标志是:
A.平衡常数K只与温度有关,与是否达到平衡状态无关,故A错误;
B.CO2的转化率不再变化,即反应达到限度,是平衡状态,故B正确;
C.反应后气体的物质的量减少,质量不变,所以混合气体的平均相对分子质量逐渐增大,当混合气体的平均相对分子质量不再改变时即是平衡状态,故C正确;
D.反应物和生成物都是气体,气体质量不变,容器体积不变时,气体密度始终不变,所以密度不变不能说明反应达到平衡状态,故D错误;
故答案为:BC;
故答案为:cd;
(Ⅱ)(1)650℃时,若在此容器中开始充入2mol H2O(g)、1mol CO、1mol CO2和 2 mol H2,此时Qc=$\frac{c(C{O}_{2})•c({H}_{2})}{c({H}_{2}O)•c(CO)}$=$\frac{0.5×1}{1×0.5}$=1,要使反应向正反向进行需满足条件:Qc<K,反应正向进行;
故答案为:正向;
(2)反应物有两种或两种以上,增大一种反应物的量可以提高另一种反应物的转化率,a2(H2O)>a3(H2O),
故答案为:>;
(Ⅲ)(1)A、根据图中转化率无法判断起始量,故A错误;
B、根据速率之比等于计量数之比可知,达平衡时,v(H2)正=3v(CO2)逆,故B错误;
C、利用三段式计算,设起始H2为2mol,则CO2为1mol,
6H2 +2CO2?C2H5OH+3H2O
起始(mol) 2 1 0 0
转化(mol)1.8 0.6
平衡(mol)0.2 0.4
H2的平衡转化率为$\frac{1.8}{2}$×100%=90%,故C正确;
D、b点温度高于c点,该反应为放热反应,升高温度平衡逆向移动,所以b点的平衡常数小于c点,故D错误;
故答案为:C;
(2)在体积为2L的密闭容积中加入0.4molCO2和0.4molH2,第4分钟达到平衡,水的浓度为0.1mol/L,在第5分钟时,向体系中再充入0.2molCO2和0.2mol H2(其他条件不变),平衡逆向移动水的浓度增大,曲线起始时水的浓度为0.1mol/L,随反应进行第8分钟达到平衡,此时水的浓度,结合平衡常数计算得到;
CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol/L) 0 0 0.2 0.2
变化量(mol/L) 0.1 0.1 0.1 0.1
平衡量(mol/L) 0.1 0.1 0.1 0.1
平衡常数K=1
在第5分钟时,向体系中再充入0.2molCO2和0.2molH2(其他条件不变),平衡逆向移动,水的浓度增大,起始量为0.1mol/L.结合化学平衡三段式列式计算,设得到平衡生成水物质的量浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol/L) 0.1 0.1 0.2 0.2
变化量(mol/L) x x x x
平衡量(mol/L) 0.1+x 0.1+x 0.2-x 0.2-x
K=$\frac{(0.2-x)^{2}}{(0.1+x)^{2}}$=1
x=0.05mol/L
平衡后水的平衡浓度为0.1mol/l+0.05mol/L=0.15mol/L,据此画出图象为: ,
,
故答案为: .
.
点评 本题考查热化学方程式书写,化学平衡影响因素分析,反应速率、反应平衡常数的计算,对图象的分析与平衡移动及平衡状态的特征的理解,难度较大,注意图象起点、终点和过程中变化趋势是画图象的关键.


科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 95.6%乙醇中的水(CaO) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 溴苯中的溴(苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
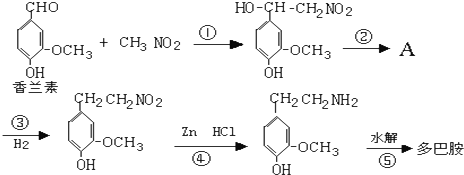
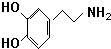 )是人体大脑中的一种有机物质叫做多巴胺.
)是人体大脑中的一种有机物质叫做多巴胺.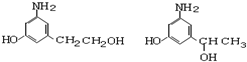 .
. 
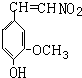 .
.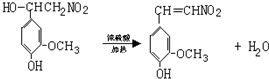 ,⑤:
,⑤: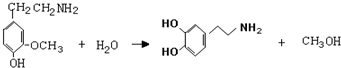 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| B. | 相同温度下,0.6 mol•L-1氨水和0.3 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 向0.1 mol•L-1NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中的c(Na+)=c(NO3-) | |
| D. | 室温下,0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):则c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 | |
| B. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
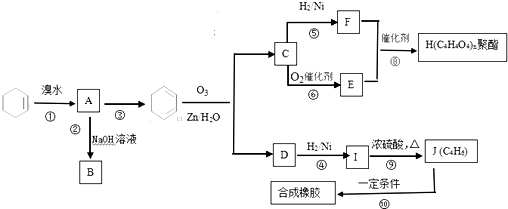
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 | |
| B. | 欲配置500 mL l mol/LNaOH溶液,应将20gNaOH固体溶于500 mL水中 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硫酸 | |
| D. | 钠着火时用二氧化碳灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com