
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol•L-1HNO2溶液的pH为3 |
分析 部分电离、溶液中存在电离平衡的电解质为弱电解质,要证明亚硝酸为弱电解质,只要证明亚硝酸部分电离即可,据此分析解答.
解答 解:A.亚硝酸溶液用水稀释后氢离子浓度下降,因为溶液体积增大,即使亚硝酸是强电解质,溶液中氢离子浓度也减小,则不能说明亚硝酸部分电离,所以不能说明亚硝酸是弱电解质,故A错误;
B.溶液导电性与离子浓度成正比,HNO2溶液的导电性比盐酸弱,说明亚硝酸中离子浓度小于盐酸,则不能说明亚硝酸部分电离,所以不能说明亚硝酸是弱电解质,故B错误;
C.亚硝酸不能和氯化钠反应,说明不具备复分解反应条件,不能说明亚硝酸部分电离,则不能说明亚硝酸是弱电解质,故C错误;
D.常温下,0.1mol•L-1HNO2溶液的pH为3,溶液中氢离子浓度小于酸浓度,则酸部分电离,为弱电解质,故D正确;
故选D.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质根本区别是解本题关键,电解质强弱与电解质溶液导电性强弱无关,为易错点.


科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硫有漂白性,通入少量紫色石蕊试液中,充分振荡后溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
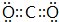 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 25℃时,1L pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| D. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
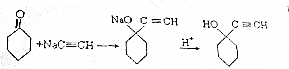
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
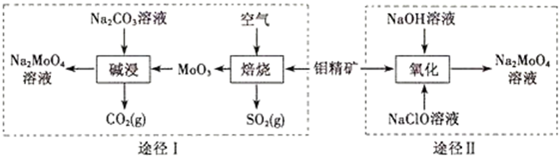

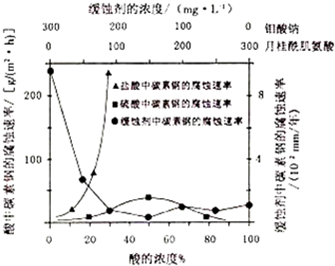
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com