
| A、5:7 | B、4:3 |
| C、3:4 | D、9:13 |
| 0.112L |
| 22.4L/mol |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:

| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、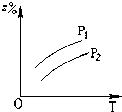 |
C、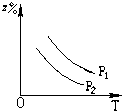 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、112mL |
| B、1008mL |
| C、224mL |
| D、336mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
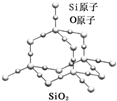
| A、晶体中Si、O原子个数比为1:2 |
| B、晶体中Si、O原子最外层都满足8电子结构 |
| C、晶体中一个硅原子含有Si-O键数目为4 |
| D、晶体中最小环上的原子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸雨 | B、臭氧空洞 |
| C、光化学烟雾 | D、温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、符合CnH2n+2通式的一定是同系物 |
| B、符合CnH2n通式的一定是同系物 |
| C、符合CnH2n-2通式的一定是同系物 |
| D、符合CnH2n-6通式的一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH+HCl═NaCl+H2O△H=+57.4kJ?mol-1 |
| B、NaOH+HCl═NaCl+H2O△H=-57.4 kJ?mol-1 |
| C、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ?mol-1 |
| D、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com