
| A. | NH4Cl溶液呈酸性:NH4++2H2O?NH3•H2O+H3O+ | |
| B. | 氨气溶于水,溶液呈碱性:NH3•H2O═NH4++OH- | |
| C. | NaHSO4溶液可以导电:NaHSO4?Na++H++SO42- | |
| D. | 常温下,饱和H2CO3溶液pH=4:H2CO3?2H++CO32- |
分析 A.氯化铵溶液中铵根离子水解生成一水合氨和氢离子,氢离子可以写成水和氢离子;
B.一水合氨是弱电解质存在电离平衡;
C.硫酸氢钠是强电解质完全电离生成钠离子、氢离子和硫酸根离子;
D.碳酸是多元弱酸分步电离;
解答 解:A.氯化铵溶液中铵根离子水解生成一水合氨和氢离子,氢离子可以写成水和氢离子,离子方程式为:NH4++2H2O?NH3•H2O+H3O+,故A正确;
B.一水合氨是弱电解质存在电离平衡,NH3•H2O?NH4++OH-,故B错误;
C.硫酸氢钠是强电解质完全电离生成钠离子、氢离子和硫酸根离子,NaHSO4=Na++H++SO42-,故C错误;
D.碳酸是多元弱酸分步电离,常温下,饱和H2CO3溶液pH=4:H2CO3?H++HCO3-,HCO3-?H++CO32-,故D错误;
故选A.
点评 本题考查了盐类水解、弱电解质电离平衡、电离方程式和水解离子方程式书写,注意氢离子可以写成水和氢离子,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
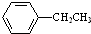 $→_{△}^{Fe_{2}O_{3}}$
$→_{△}^{Fe_{2}O_{3}}$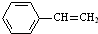 +H2,下列说法正确的是( )
+H2,下列说法正确的是( )| A. | 该反应的类型为消去反应 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

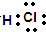 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KI+Cl2═2KCl+I2 | B. | C2H5Cl+H2O C2H5OH+HCl C2H5OH+HCl | ||
| C. | nCH2═CH2$\stackrel{催化剂}{→}$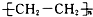 | D. | 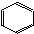 +3H2$→_{△}^{催化剂}$ +3H2$→_{△}^{催化剂}$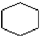 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
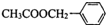 )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下: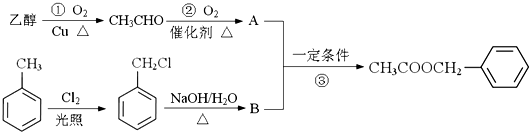
 制备
制备 C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A
C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | H2CO3 | HClO | HAlO2 |
| 电离常数 (25℃) | Ka1=4.4×10-7 | Ka=3×10-8 | Ka=6.3×10-13 |
| Ka2=4.7×10-11 |
| A. | NaClO溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | NaAlO2溶液中加入过量CO2:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═CO32-+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| B. | 向试管中滴加液体时,胶头滴管不能伸入试管 | |
| C. | 将FeCl3饱和溶液滴入热的稀氢氧化钠溶液中制备氢氧化铁胶体 | |
| D. | 金属钠着火时,用干燥的沙土覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
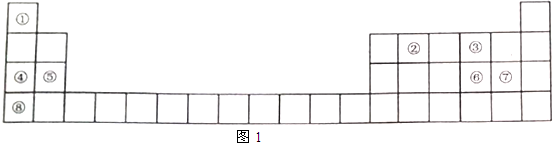
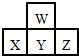 如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是Z>Y>X>W | |
| B. | Z的气态氢化物比X的气态氢化物稳定 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | X、Y、Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com