
【题目】脱氢醋酸钠是FAO和WHO认可的一种安全型食品防霉、防腐保鲜剂,它是脱氢醋酸的钠盐。脱氢醋酸的一种制备方法如图:
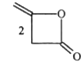 (a双乙烯酮)
(a双乙烯酮)![]()
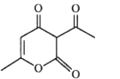 (b脱氢醋酸)
(b脱氢醋酸)
下列说法错误的是
A.a分子中所有原子处于同一平面B.a.b均能使酸性KMnO4溶液褪色
C.a、b均能与NaOH溶液发生反应D.b与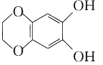 互为同分异构体
互为同分异构体
科目:高中化学 来源: 题型:
【题目】下表是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种短周期元素的某些性质:
五种短周期元素的某些性质:
元素 | A | B | C | D | E |
最低负化合价 |
|
|
|
|
|
电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
下列判断正确的是( )
A.![]() 、
、![]() 、
、![]() 的简单氢化物的稳定性:
的简单氢化物的稳定性:![]()
![]() 元素原子的最外层原子轨道中无自旋状态相同的电子
元素原子的最外层原子轨道中无自旋状态相同的电子
C.![]() 元素与
元素与![]() 元素不可能形成化合物
元素不可能形成化合物
D.与![]() 元素同周期的第一电离能最小的元素的单质能与
元素同周期的第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是( )

A.图甲:进行中和热的测定
B.图乙:比较 HCl、H2CO3和H2SiO3的酸性强弱
C.图丙:验证 CuCl2对 H2O2 分解有催化作用
D.图丁:验证 2NO2(g)![]() N2O4 (g) △H<0
N2O4 (g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是
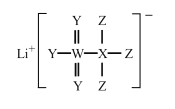
A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解冶炼铝的过程中加入冰晶石(Na3AlF6)可起到降低Al2O3熔点的作用。
(1)基态氟原子中,电子占据的最高能层的符号为______,电子占据最高能级上的电子数为______。
(2)向NaAlO2及氟化钠溶液中通入CO2,可制得冰晶石。
①该反应中涉及的非金属元素的电负性由大到小的顺序为______________。
②1molCO2中含有的σ键数目为________,其中C原子的杂化方式为_________;CO2与SCNˉ互为等电子体,SCNˉ的电子式为_________。
③Na2O的熔点比NaF的高,其理由是:_________。
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处△所代表的微粒是________(填微粒符号)。
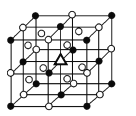
(4)冰晶石稀溶液中存在的化学键有________(填标号)。
A 离子键 B 共价键 C 配位键 D 氢键
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其晶胞参数为apm,则铝原子的半径为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式如图所示,下列有关该物质的说法不正确的是
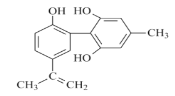
A.A分子中的所有碳原子可能共平面
B.1mol A与碳酸钠溶液反应,最少消耗1.5mol Na2CO3
C.向A中滴入酸性KMnO4溶液,紫色褪去,不能证明A的结构中存存碳碳双键
D.1mol A分别与浓溴水和H2反应,最多消耗的Br2和H2的物质的量分别为4mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学模拟工业制碘的方法,探究ClO3-和I-的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 1 | 0.05mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
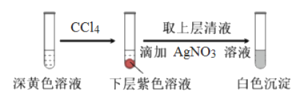
经检验,上述白色沉淀是AgCl。写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式____________。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2,反应的离子方程式是______________________。
进行实验:取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X可以是_________(填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
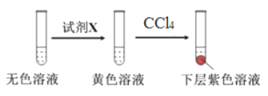
获得结论:NaClO3溶液用量增加导致溶液褪色。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0mol·L-1H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25mL | 浅黄色 | 无色 |
6 | 0.85mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是______________________。
②实验6中ClO3-和I-反应的离子方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“宏观——微观——符号”之间建立联系是化学学科特有的思维方式。如图是科研人员提出的HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程示意图(图中只画出了HAP的部分结构)。下列说法不正确的是
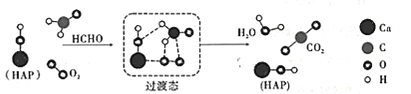
A.HAP能降低HCHO与O2反应的活化能
B.该反应的化学方程式为HCHO+O2![]() CO2+H2O
CO2+H2O
C.反应过程中断裂或生成的的化学键类型均为极性共价键
D.产物CO2分子中的氧原子不仅仅来源于O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢大量存在于天然气及液化石油气中,近年来发现![]() 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解![]() 包括下列反应:
包括下列反应:
Ⅰ.![]()
Ⅱ.![]()
Ⅲ.![]()
①![]() =____________(用
=____________(用![]() 表示)。
表示)。
②已知单质硫气态时以![]() 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339![]() 、E(H-H)=436
、E(H-H)=436![]() 、E(S=S)=225
、E(S=S)=225![]() ,则
,则![]() =____________
=____________![]() 。
。
③![]() 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价,![]() 的电子式为______________。
的电子式为______________。
(2)银器长期露置在含![]() 的空气中表面会生成
的空气中表面会生成![]() 而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
(3)实验室用粗锌制取氢气时常含有少量的![]() ,可用酸性
,可用酸性![]() 溶液(
溶液(![]() 被还原为
被还原为![]() )将
)将![]() 氧化为S而除去,该反应的离子方程式为_______。
氧化为S而除去,该反应的离子方程式为_______。
(4)![]() 与
与![]() 合成硫醇
合成硫醇![]() 的反应
的反应![]() 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时![]() 的平衡转化率如图所示:
的平衡转化率如图所示:
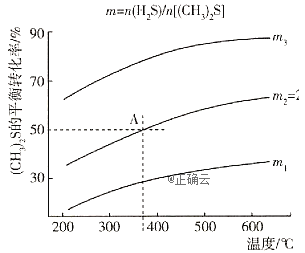
①该反应的![]() ______0(填“>”或“<");
______0(填“>”或“<");![]() _________
_________![]() (填“>”或“<”)。
(填“>”或“<”)。
②在2L密闭容器中充入0.2mol![]() 和0.1mol
和0.1mol![]() ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
③为提高![]() 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com